- производство удобрений (селитры);
- производство красителей, лаков, полимеров и пластмасс, искусственных волокон;
- производство ВВ и лекарств;
-окислитель в ракетном топливе.
Соли азотной кислоты (нитраты) – твердые кристаллические вещества, хорошо растворимы, токсичны. В растворах окислительные свойства не проявляют. При нагревании разлагаются. Ход реакции зависит от положения металла в электрохимическом ряду. Например:
Если Ме стоит до Mg: KNO3 → KNO2 + O2
Если Ме стоит между Mg и Cu: Pb(NO3)2→PbO + NO2+ O2
Если Ме стоит после Cu: AgNO3→ Ag + NO2 + O2
Применение. Большая часть – в виде минеральных удобрений (селитры), некоторые соли используют в пиротехнике, AgNO3 (ляпис) в медицине.
 Роль азота в организме и использование соединений азота. Содержание азота в организме 3,1%, входит в состав всех белков и нуклеотидов, а значит и всех БАВ. В составе ферментов, гормонов участвует во всех обменах веществ. В медицине используется: жидкий азот – эффективное средство для лечения кожных заболеваний; N2O – для анестезии, при предынфарктных состояниях, для профилактики травматического шока; нашатырный спирт (10% водный раствор NH3) раздражает рецепторы дыхательных путей, возбуждает ЦНС, поэтому он используется при обмороках и алкогольных отравлениях; аммиак обладает противомикробным действием и используется как моющее и дезинфицирующее средство; NaNO2 –спазмолитическое средство, используется при лечении стенокардии и как антидот; NH4Cl – используют как мочегонное и отхаркивающее средство.
Роль азота в организме и использование соединений азота. Содержание азота в организме 3,1%, входит в состав всех белков и нуклеотидов, а значит и всех БАВ. В составе ферментов, гормонов участвует во всех обменах веществ. В медицине используется: жидкий азот – эффективное средство для лечения кожных заболеваний; N2O – для анестезии, при предынфарктных состояниях, для профилактики травматического шока; нашатырный спирт (10% водный раствор NH3) раздражает рецепторы дыхательных путей, возбуждает ЦНС, поэтому он используется при обмороках и алкогольных отравлениях; аммиак обладает противомикробным действием и используется как моющее и дезинфицирующее средство; NaNO2 –спазмолитическое средство, используется при лечении стенокардии и как антидот; NH4Cl – используют как мочегонное и отхаркивающее средство.
|
|
|
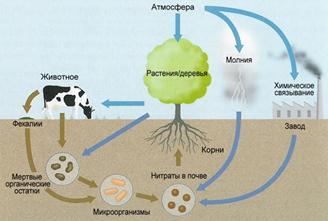
Круговорот азота в природе. Азот, как и другие химические элементы, в природе находится в постоянном «движении». Это «движение» надо понимать, как превращение одних соединений азота в другие. Атомы азота как бы переходят из одних молекул в другие, этот переход иногда называют биогенной миграцией, т.к. в ней принимают участиеживые организмы.
 2015-02-18
2015-02-18 1217
1217







