При изучении данной темы необходимо обратить внимание на:
· сходство и различие между гравиметрическим и титриметрическим методами анализа;
· способы выражения концентраций растворов в титриметрии;
· расчеты, производимые в титириметричсеском анализе.
Для решения задач в титриметрическом методе следует повторить из курса “Химия” понятие эквивалента для всех классов неорганических соединений, т. к. основным законом в количественном методе анализа является закон эквивалентов. Кроме того, из этого же курса нужно повторить тему “Различные способы выражения концентрации растворов”.
Кроме рассмотренных ранее способов выражения концентрации растворов, в титриметрическом методе используется такое понятие как титр.
Титр раствора – масса вещества Х, содержащаяся в одном кубическом сантиметре раствора.
Т = 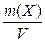 (г/см3) (1)
(г/см3) (1)
где: m(Х) – масса вещества (Х), г;
V – объем раствора, см3;
Т – титр раствора, г ⁄см-3.
Титр рабочего вещества:
Т(р.в.) = 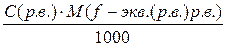 (2)
(2)
где: С(р.в.) – молярная концентрация эквивалента рабочего вещества, (моль/ дм3);
М(f экв(р.в.) р.в.) – молярная масса эквивалента рабочего вещества, (г/моль).
Титр рабочего вещества по определяемому веществу равен:
Т(р.в./ о.в.) = 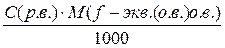 (3)
(3)
где: С(р.в.) – молярная концентрация эквивалента рабочего вещества, (моль/дм3);
М(f экв(о.в.) о.в.) – молярная масса эквивалента определяемого вещества, (г/моль).
Если речь идет об одном веществе, то используют титр рабочего вещества, если одно вещество используют для определения второго, то для расчета пользуются титром по определяемому веществу. Титр расчитывается с точностью до седьмого знака ± 0,0000002.
Для приготовления раствора заданного титра (Т) в объеме (V) рассчитывается масса навески химически чистого растворенного вещества.
mнав. ═ Т × V (г) (4)
Если в условии задачи по результатам титрования даны объемы реагирующих веществ и молярная концентрация эквивалента одного из реагирующих веществ, тогда из отношения
С1• V1 = С2 • V2 (5)
можно определить молярную концентрацию эквивалента другого вещества.
C1 = 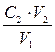
Приготовить раствор строго заданной концентрации не всегда удается, поэтому пользуются поправочными коэффициентом «К».
К = 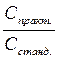 (6)
(6)
где: Спрак. – практически полученная молярная концентрация эквивалента рабочего вещества (моль / дм3);
Сстанд. – стандартная молярная концентрация эквивалента рабочего вещества, (моль ⁄ дм3)
С целью стандартизации расчетных формул в заводских химических лабораториях пользуются краткими величинами молярных концентраций эквивалента рабочих растворов. Чаще всего 0,1 моль / дм3; 0,01 моль / дм3; 0,5 моль /дм3; 0.05 моль/дм3; 0,2 моль / дм3. Поправочный коэффициент величина всегда близкая к единице.
Заключительным моментом в проведении анализа является расчет массы определяемого вещества.
В основу расчета массы положена формула:
m (о.в.) = Т (р.в./о.в.) × V (р.р.) (7)
Например: Для установления точной концентрации пипеткой отобрали 25,00 см3 раствора NaOH, на титрование которого затратили 23,61 см3 раствора соляной кислоты с титром 0,0040230 г/см3. Вычислить титр раствора щелочи и его титр по соляной кислоте.
Дано: Решение:
 |
V(NaOH) = 25,00 cм3 1.1 Определяем молярную концентрацию эквивалента вещества соляной
V(HCl) = 23,61 см3 кислоты:
 Т(HCl) = 0,0040230 г/см3 Т(HCl) =
Т(HCl) = 0,0040230 г/см3 Т(HCl) = 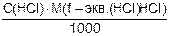
Т(NaOH) −? С(HCl)= 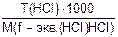 =
= 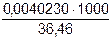 = 0,11034 моль/дм3
= 0,11034 моль/дм3
Т(NaOH/HCl) −? 1.2 Определяем молярную концентрацию эквивалента вещества щелочи:
С(NaOH) = 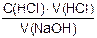 =
= 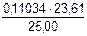 = 0,1043 моль/см3
= 0,1043 моль/см3
1.3 Определяем титр раствора щелочи:
Т(NaOH) = 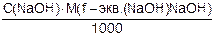 =
= 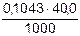 = 0,0041720 г/см3
= 0,0041720 г/см3
1.4 Определяем титр раствора щелочи по соляной кислоте:
Т(NaOH/HCl) = 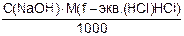 =
= 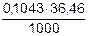 = 0,0038028 г/см3
= 0,0038028 г/см3
Ответ:Т(NaOH) = 0,0041720 г/см3 , Т(NaOH/HCl) = 0,0038028 г/см3
Вопросы для самоконтроля
1. В чём сходство и различие между гравиметрическим и титриметрическим методами анализа?
2. Как определяется молярная масса эквивалента вещества в реакциях ионного обмена?
3. Что такое титрованный раствор?
4. Что такое поправочный коэффициент?
5. Что такое титр рабочего раствора? Что такое титр рабочего раствора по определяему веществу?
6. Что такое точка эквивалентности и как она устанавливается при титровании?
7. Как готовят титрованные растворы?
8. В чём заключается сущность титрований:
8.1. прямого;
8.2. по остатку;
8.3. методом замещения?
Литература [3], с.92-114.
 2015-03-07
2015-03-07 1425
1425








