Температура горения зависит от состава горючего материала, условий горения: разбавления продуктов горения избыточным воздухом, температуры воздуха, полноты сгорания исходного горючего материала.
Задача вычисления адиабатической температуры горения сводится к нахождению такой температуры (Т'), при которой наблюдается равенство внутренних энергий исходных веществ и продуктов их горения.
Расчет температуры горения может быть осуществлен так же из уравнения энергетического баланса:
QH · (I- η) = V пг пр · Cp· (Tг- T0),
где:
Qн - тепло, выделяемое при реакции горения, кДж,
V пг пр - объём продуктов полного горения с учетом избытка воздуха, м3.
Ср- средняя объемная теплоёмкость продуктов горения при постоянном давлении; кДж/(м3·К),
Тг - температура горения, К,
Т0 - начальная температура, К.
Следовательно, чтобы рассчитать температуру горения, необходимо знать теплоту горения, объём и теплоёмкость продуктов горения.
В первом приближении температуру горения можно рассчитать непосредственно из уравнения теплового баланса, имея в виду, что средняя теплоёмкость продуктов горения в интервале температур 1500 - 2500 К может быть принята равной 1,75 кДж/(м3·К).
|
|
|
При выполнении расчёта температуры горения значения теплоемкостей продуктов горения берут из таблиц, а подсчет производят по методу последовательных приближений, каждый раз определяя теплосодержание продуктов горения при выбранной температуре.
В таблицах 3 и 4 приведены энтальпии газов - СрТ, отнесённые к молю или м3.
Важно иметь в виду, какой таблицей пользоваться, что зависит от того, в чем рассчитано количество продуктов горения (кмоль или м3).
Низшая теплота сгорания горючего принимается по справочной литературе, а также может быть определена расчетным методом. В настоящей работе допускается использовать теплоту сгорания рассчитанную в п.2.4.
В общем виде алгоритм вычисления температуры горения можно представить следующим образом:
1. Рассчитывается низшая теплота горения вещества;
2. Вычисляется количество продуктов горения, образующихся из единицы массы или объема горючего вещества.
3. Определяется средняя энтальпия (теплосодержание) продуктов горения с учетом теплопотерь в окружающую среду;
4. По значению средней энтальпии продуктов горения, с помощью справочной литературы по таблицам «Теплосодержание газов при постоянном давлении», ориентируясь на азот, приближенно определяем температуру горения.
5. Методом итераций (последовательных приближений) вычисляется температура горения: определяют теплосодержание продуктов горения при выбранной температуре, затем сравнивают ее с количеством тепла, выделяющегося при горении с учетом теплопотерь. Далее или понижают или повышают предполагаемую температуру горения и снова определяют теплосодержание ПГ. Снова сравнивают с количеством тепла, выделяющегося при горении с учетом теплопотерь. Так до тех пор, пока не будет определен интервал температур, в котором находится искомая температура горения. После этого методом интерполяции определяют температуру горения при заданных условиях.
|
|
|
Если потери теплоты не учитывались, то получается адиабатическая, а если учитывались, то - действительная температура горения.
Таблица 3. Теплосодержание газов при различных температурах (кДж/кмоль)
| Температура воздуха (Т-273)К | Теплосодержание, кДж/кмоль | |||||
| Кислород | Азот | Воздух | Углекислый газ | Вода | Оксид серы | |
| 15678.9 | 14945.7 | 15058.8 | 22303.4 | 17828.4 | 23275.4 | |
| 19072.9 | 18104.9 | 18255.8 | 27473.8 | 21733.5 | 28533.9 | |
| 22521.2 | 21331.3 | 21524.0 | 32795.1 | 25772.7 | 33876.1 | |
| 26019.9 | 24616.2 | 24842.5 | 38237.9 | 29937.5 | 39385.5 | |
| 29564.6 | 27955.7 | 28211.3 | 43785.5 | 34232.3 | 44799.5 | |
| 33142.9 | 31337.0 | 31621.9 | 49442.0 | 38648.5 | 50321.9 | |
| 36750.5 | 34760.2 | 35074.5 | 55140.4 | 43198.9 | 55907.2 | |
| 40391.6 | 38221.2 | 38560.6 | 60922.6 | 47807.9 | 61492.4 | |
| 44036.9 | 41719.8 | 42067.6 | 66788.6 | 52584.5 | 67161.5 | |
| 47724.1 | 45252.0 | 45629.1 | 72654.6 | 57403.0 | 72797.1 | |
| 51453.2 | 48771.6 | 49190.6 | 78562.5 | 62347.2 | 78436.8 | |
| 55182.3 | 52375.0 | 52794.0 | 84554.2 | 67333.3 | 84135.2 | |
| 58953.3 | 55936.5 | 56397.4 | 90545.9 | 72445.1 | 89821.0 | |
| 62766.2 | 59539.9 | 66000.8 | 96579.5 | 77598.8 | 95557.1 | |
| 66579.1 | 63143.3 | 63646.1 | 102613.1 | 82794.4 | 101184.3 | |
| 70392.0 | 66788.6 | 67333.3 | 108646.7 | 88073.8 | 107012.6 | |
| 74246.8 | 70433.9 | 71020.5 | 114722.2 | 93395.1 | 112715.2 | |
| 78101.6 | 74121.1 | 74707.7 | 120839.6 | 98758.3 | 118451.3 | |
| 81998.3 | 77766.4 | 78394.9 | 126915.1 | 104163.4 | 124220.9 | |
| 85936.9 | 81453.6 | 82124.0 | 133032.5 | 109631.3 | 130024.1 | |
| 89875.5 | 85140.8 | 85853.1 | 139149.9 | 115141.1 | 135756.0 | |
| 94015.2 | 89003.9 | 89330.8 | 145325.9 | 119398.2 | 141513.0 | |
| 97857.4 | 92653.5 | 93105.9 | 151481.1 | 124782.4 | 147295.2 |
Таблица 4. Теплоемкость газов при различных температурах (кДж/м3)
| Температура воздуха (Т-273)К | Теплосодержание, кДж/кмоль | |||||
| Кислород | Азот | Воздух | Углекислый газ | Вода | Оксид серы | |
| 669.3 | 666.6 | 672.0 | 925.1 | 586.2 | 1034.9 | |
| 850.6 | 807.8 | 814.5 | 1225.6 | 969.5 | 1269.6 | |
| 1004.7 | 951.9 | 960.3 | 1463.1 | 1149.7 | 1507.5 | |
| 1160.6 | 1098.2 | 1108.2 | 1706.2 | 1335.3 | 1746.4 | |
| 1319.0 | 1206.9 | 1258.7 | 1953.8 | 1527.2 | 1994.8 | |
| 1478.6 | 1398.2 | 1410.7 | 2205.2 | 1724.2 | 2237.4 | |
| 1639.5 | 1551.1 | 1564.9 | 2460.4 | 1926.5 | 2488.8 | |
| 1802.1 | 1705.3 | 1720.4 | 2718.5 | 2133.9 | 2735.2 | |
| 1965.1 | 1861.2 | 1877.5 | 2979.1 | 2345.5 | 2979.5 | |
| 2129.8 | 1808.8 | 2035.5 | 3241.4 | 2560.9 | 3238.0 | |
| 2295.7 | 2176.7 | 2194.7 | 3505.7 | 2781.3 | 3488.2 | |
| 2462.4 | 2335.5 | 2355.2 | 3771.4 | 3004.2 | 3747.5 | |
| 2630.5 | 2495.9 | 2515.7 | 4039.6 | 3231.7 | 4003.1 | |
| 2799.7 | 2656.9 | 2678.2 | 4307.3 | 3461.3 | 4161.2 | |
| 2669.4 | 2818.2 | 2840.4 | 4579.5 | 3693.5 | 4529.8 | |
| 3140.8 | 2979.9 | 3004.2 | 4847.8 | 3928.5 | 4667.6 | |
| 3311.7 | 3142.9 | 3167.6 | 5118.2 | 4166.1 | 5059.4 | |
| 3497.8 | 3306.3 | 3332.3 | 5392.5 | 4405.8 | 5337.2 | |
| 3559.1 | 3469.3 | 3497.4 | 5660.7 | 4667.1 | 5608.7 | |
| 3834.3 | 3633.1 | 3663.3 | 5933.0 | 4890.9 | 5892.8 | |
| 4009.8 | 3797.4 | 3828.8 | 6209.6 | 5136.5 | 6169.8 | |
| 4184.9 | 3553.9 | 3988.4 | 6487.4 | 5387.1 | 6460.1 | |
| 4368.9 | 4135.9 | 4156.5 | 6761.8 | 5639.3 | 6753.8 |
Пример: Вычислить действительную температуру горения анилина С6Н5NH2, если потери тепла излучением составляют 20 %, а горение протекает с коэффициентом избытка воздуха 1,1.
1. Составляем уравнение реакции горения анилина:
С6Н5NH2 + 7,75(O2 + 3,76 N2) = 6 CO2 + 3,5 H2O + 7,75×3,76 N2 + 0,5 N2
2. По уравнению реакции горения определяем количество киломоль продуктов горения:
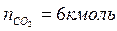
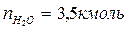
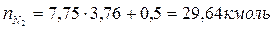
Поскольку в рассматриваемом случае горение протекает с избытком воздуха (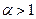 ), необходимо учесть остаточный кислород в продуктах сгорания и азот в избытке воздуха:
), необходимо учесть остаточный кислород в продуктах сгорания и азот в избытке воздуха:
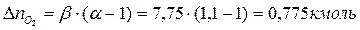
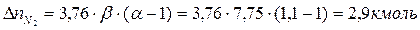
Таким образом, практический состав продуктов сгорания следующий:
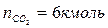
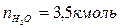
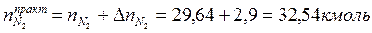
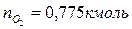
Определяем общее количество продуктов сгорания при сжигании 1 киломоля горючего:
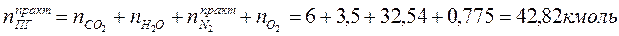
3. Определяем среднее теплосодержание продуктов горения
Теплота горения анилина составляет:
Qгор = 32386, кДж/кг
Поскольку расчет ведется на 1 кмоль, необходимо перевести эту величину в кДж/кмоль:
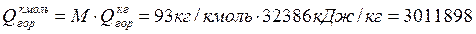 кДж/кмоль
кДж/кмоль
По условию задачи теплопотери составляют 20 %, следовательно, h = 0,2.
|
|
|
QПГ = 3011898 (1 – 0,2) = 2409518,4кДж/моль
Среднее теплосодержание продуктов горения:
Qср = 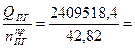 56270,8кДж
56270,8кДж
4. По справочным данным, ориентируясь на азот (табл. 4), определяем Т1 = 17000С
5. Рассчитываем теплосодержание продуктов горения
QПГ1700 = 90545,9×6 + 72445,1×3,5 + 55936,5×32,54 + 58953,3·0,775= 543275,4+253557,85+1820173,71+45688,8=2662696 кДж
QПГ1700 = 2662696 > QПГ = 2409518,4, следовательно, выбираем Т2 = 16000С
Рассчитываем теплосодержание продуктов горения при 16000С.
QПГ1600 =84554.2·6+67333,3·3,5+52375·32,54+55182,3·0,775=2490041кДж
QПГ1600 = 2490041 > QПГ = 2409518,4, следовательно, выбираем Т3 = 15000С
Рассчитываем теплосодержание продуктов горения при 15000С.
QПГ1500 =78562.5·6+62347.2·3,5+48771.6·32,54+51453.2·0,775=2316494кДж
QПГ1500 = 2316494 < QПГ = 2409518,4, следовательно температура горения находится в интервале от 1500 до 16000С.
6. Методом интерполяции рассчитываем температуру горения:
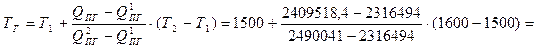 1553
1553
Ответ: температура горения анилина при заданных условиях составляет 1553 К.
Если потери тепла не учитывались, то получаем адиабатическую температуру горения, а если учитывались, то - действительную температуру горения вещества.
Пример 2. Вычислить действительную температуру горения горючего сланца следующего состава: С – 35 %, Н – 5 %, О – 10 %, S – 4 %, N – 1 %, W – 15 %, зола – 30 %. Потери тепла излучением составляют 10 %, а горение протекает с коэффициентом избытка воздуха 1,2. Условия нормальные.
1. Определяем объем каждого компонента продуктов горения 1 кг горючего сланца.
V(СО2) = 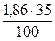 = 0,651 м3
= 0,651 м3
V(H2O) = 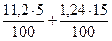 = 0,746 м3
= 0,746 м3
V(SО2) = 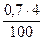 = 0,028 м3
= 0,028 м3
V(N2) = 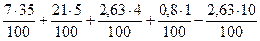 = 3,455 м3
= 3,455 м3
VПГ = 0,651 + 0,746 + 0,028 + 3,455 = 4,88 м3
2. Горение протекает с коэффициентом избытка воздуха 1,2, следовательно, в состав продуктов горения будет входить избыточный воздух.
Определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
Vвтеор =  = 4,28 м3
= 4,28 м3
Определяем избыток воздуха:
DVв= Vвтеор(a -1) = 4,28×(1,2 – 1) = 0,856 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + DVв = 4,88 + 0,856 = 5,736 м3
3. Рассчитываем Qн по формуле Д.И. Менделеева.
Qн = 339,4×35 + 1257×5 – 108,9×(10 + 1 – 4) – 25,1×(9×5 + 15) = 15881,7 кДж/кг
4. С учетом теплопотерь определяем теплосодержание продуктов горения:
|
|
|
QПГ = 15881,7 (1,1 – 1) = 14293,53 кДж/кг
5. Определяем среднее теплосодержание продуктов горения:
Qср = 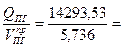 2480,22 кДж/м3
2480,22 кДж/м3
По таблице 3, ориентируясь на азот, определяем Т1 = 15000С.
6. Определяем теплосодержание продуктов горения при 15000С:
QПГ1500 = 3505,7×0,651 + 2781,3×0,746 + 2176,7×3,455 + 3488,2×0,028 + 2194,7×0,856 = 13853,889 кДж
7. QПГ1500 = 13853,889 < QПГ = 14293,53, следовательно, выбираем Т2 = 16000С.
8. Определяем теплосодержание продуктов горения при 16000С:
QПГ1600 = 3771,4×0,651 + 3004,2×0,746 + 2335,5×3,455 + 3747,5×0,028 + 2355,2×0,856 = 14886,44 кДж
9. QПГ1600= 14886,44 > QПГ = 14293,53, следовательно, температура горения вещества находится в интервале от 1500 до 16000С.
10. Определяем температуру горения:
ТГ =1500 + 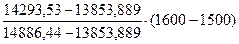 = 15560С = 1829 К
= 15560С = 1829 К
Ответ: температура горения горючего сланца при заданных условиях составляет 1829 К.
 2015-03-27
2015-03-27 12507
12507
