На окисление сернистого ангидрида по реакции 2SO2 +O2 Û 2SO3+Q поступает N0 =500 кмоль/ч SO2. Для окисления используют воздух в стехиометрическом количестве. ХSO2 =0,8. рассчитать материальный баланс процесса.
Решение
Рассчитываем количество SO2, вступившего в химическую реакцию:
NSO2,xp = NSO2, 0×X SO2;
По уравнению химической реакции определяем количество кислорода и серного ангидрида:
NO2,xp = 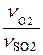 NSO2×ХSO2 =
NSO2×ХSO2 = 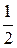 ×500×0,8 = 200 кмоль/ч
×500×0,8 = 200 кмоль/ч
NSO3,xp = 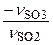 NSO2, 0×X SO2 =
NSO2, 0×X SO2 = 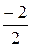 500×0,8 = -400 кмоль/ч
500×0,8 = -400 кмоль/ч
Из воздуха вместе с кислородом поступит азот (см. табл.1.1):
NN2 = 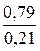 NO2 =3,76×200 = 752 кмоль/ч
NO2 =3,76×200 = 752 кмоль/ч
Найденные значения для кислорода и азота заносим в приходную часть баланса. Кислород, как второй участник химического взаимодействия, попадает также в столбец «Реакция». Азот – инертный компонент, в реакции не участвует, поэтому в расходе его количество остается неизменным. Далее решение выполняем в табличном виде (табл.1.5).
Таблица 1.5.
Сводная таблица материального баланса
| В-во | Mi, кг/кмоль | ПРИХОД | Реакция | РАСХОД | |||
| ni,0, кмоль/ч | mi,0, кг/ч | ni | ni,х, кмоль/ч | ni, кмоль/ч | mi, кг/ч | ||
| SO2 | 500×64= | 500×0,8=400 | 500 – 400=100 | ||||
| О2 | 32×200=6400 | 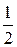 500×0,8=200 500×0,8=200 | 200 – 200=0 | ||||
| N2 | 752×28=21056 | 752 – 0=752 | |||||
| SO3 | -2 | 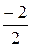 500×0,8=-400 500×0,8=-400 | 0-(-400)=400 | ||||
| ВСЕГО |
Внимание! Баланс должен сходиться только в массовых единицах. В мольных единицах он может сходиться лишь в том случае, если реакция идет без изменения объема.
 2015-03-08
2015-03-08 923
923








