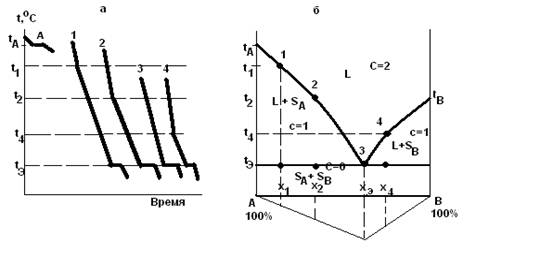
Рассмотрим систему из двух веществ А и В (К=2), температуры кристаллизации (плавления) которых tА и tВ. Если не происходит переохлаждения, то для чистого вещества А кривая охлаждения (кривая А рис. 1.2) имеет горизонтальную площадку при температуре tА.
D
F
Рис. 1.2 Кривые охлаждения (а) и диаграмма плавкости и треугольник Таммана (б) двухкомпонентной системы.
Для смеси А и В состава x1 температура начала кристаллизации вещества А t1 ниже температуры ta. На кривой охлаждения (рис. 1.2) системы состава x1 началу кристаллизации вещества А соответствует излом при температуре t1. В процессе кристаллизации компонента А его концентрация в жидкости уменьшается, а концентрация В увеличивается, что и приводит к постепенному понижению температуры кристаллизации А вплоть до tэ. По правилу фаз в ходе кристаллизации вещества А из раствора система, содержащая 2 компонентп и 2 фазы, имеет одну степень свободы (С=2-2+1=1), поэтому температура кристаллизации изменяется. Снижение скорости охлаждения системы при температурах ниже t1 связано с выделением в системе теплоты кристаллизации. При температуре tэ жидкий раствор становится насыщенным в отношении вещества В, которое при этих условиях также начинает кристаллизоваться. Система становится трехфазной (жидкость, кристаллы и кристаллы В), и число ее степеней свободы равно нулю (С=2-3+1=0). Таким образом, одновременная кристаллизация А и В из раствора происходит при постоянных температуре (tэ) и составе жидкого раствора (xэ).Эта температура называется эвтектической. На кривой охлаждения 1(рис.1.2) процессу одновременной кристаллизации А и В соответствует площадка при tэ. Расплав, из которого одновременно выпадают кристаллы А и В, называется эвтектическим расплавом, образующаяся при этом смесь мелких кристаллов двух веществ называется эвтектикой. Ниже tэ, система содержит две фазы (кристаллы А и кристаллы B) и число степеней свободы равно 1 (C=2-2+1=1).
Для смеси состава x2 (кривая 2 (рис. 1.2)), содержащей больше веществ В, чем смесь x1, кристаллизация А начинается, в соответствии со сказанным ранее, при более низкой температуре t2. Когда выпадение кристаллов А приведёт к такой концентрации вещества В, что оно также начнёт кристаллизоваться, то температура одновременной кристаллизации A и В будет такой же, как и для смеси 1. Если же взять смесь xэ, состав которой позволяет веществам А и В кристаллизоваться одновременно без предварительного выпадения кристаллов А или кристаллов В, то кривая охлаждения будет изображаться как кривая 3(охлаждение расплава эвтектического состава). Для смеси x4, содержащей избыток вещества В по сравнению с концентрацией xэ, кривая охлаждения подобна кривой 2, но сначала выпадают кристаллы В, и только при достижении состава раствора, допускающего одновременную кристаллизацию А и В, наблюдается горизонтальная площадка при температуре tэ.
Чем ближе по составу расплав к эвтектике, тем длиннее горизонтальные участки на кривых охлаждения, так как масса эвтектики увеличивается.
Диаграмма состояния двухкомпонентной системы в координатах температура-состав (рис. 1.2,б) строится на основании кривых охлаждения и называется диаграммой плавкости. Например, для чистого вещества А (левая ось ординат диаграммы плавкости) температура кристаллизации tА, для смеси x1, содержащей 20% вещества В, кристаллизация начинается при температуре t1, что на диаграмме соответствует точке 1. Для смесей x2, xЭ и x4 начало кристаллизации показано точками 2, 3 и 4. Следовательно, область диаграммы над линией tА3 и tB3 соответствует жидкому состоянию системы. Такие линии называют линиями ликвидуса от латинского слова liquidus (жидкость), и область диаграммы над ней обозначают буквой L. Твёрдое тело по латыни называется solidus, поэтому существование твердой фазы в области диаграммы обозначают буквой S.
Области диаграммы между кривой ta3,tb3 и прямой tЭD отвечают двухфазным (гетерогенным) состояниям системы, так как в ней при этих условиях присутствуют жидкость и кристаллы веществ А или В. Как видно из диаграммы(рис. 1.2.б) есть две области L + S: в левой - жидкая фаза находится в равновесии с кристаллами вещества A (L + SА), а в правой - с кристаллами вещества В (L + SВ). Область диаграммы под прямой tЭD соответствует двум твёрдым фазам и обозначается как (SА + SВ), потому что система в данном случае состоит из смеси кристаллов А и В. Система из трех фаз может существовать только при температуре tЭ ( линия tЭD).
Если на диаграмме отложить по вертикали вниз отрезки, пропорциональные или равные длинам горизонтальных участков(площадок) от оси состава для всех исследованных смесей, и соединить их концы, то можно получить треугольник Таммана (∆ABF). Причем максимальную эвтектическую площадку имеет смесь эвтектического состава. Этот треугольник позволяет экстраполяцией определить эвтектический состав, если он не попал в составы исследуемых смесей.
Таким образом, получив из опыта кривые охлаждения ряда смесей с известным соотношением двух данных компонентов, можно построить диаграмму плавкости.
 2015-03-20
2015-03-20 788
788








