Выполнение опыта. U-образную трубку электролизера (рис.), закрепленную на штативе заполнить 2 н. раствором Na2SO4, добавить в оба отверстия электролизера по 3 – 4 капли нейтрального раствора лакмуса, опустить чистые графитовые электроды и подключить их через выпрямитель к сети. Установить напряжение 5 – 15В. Электрический ток пропускать в течение 5 – 6 мин. Наблюдать выделение газов и изменение окраски индикатора в катодном и анодном пространствах.
Очевидно, что при электролизе водного раствора соли, например Na2SO4, на катоде разряжаются не ионы Na+ , а ионы водорода образуя молекулы Н2 поскольку потенциал системы Na+ + ē = Na составляет –2,7 В, а потенциал системы H+ + ē = H в нейтральной среде составляет –0,41 В. На аноде происходит выделение кислорода (j 0 = 0,82 В). Потенциал разряда иона SO42– (j 0 = +2,01 В) имеет большое положительное значение, поэтому сульфат-ионы из водных растворов не разряжаются. Процесс сводится, таким образом, к электролизу воды; ионы Na+ и SO42- наряду с остальными ионами раствора принимают участие только в переносе электрического тока в растворе. Количество Na2SO4 при электролизе остается неизменным.
|
|
|
Составить уравнения катодного и анодного процессов. Нарисовать установку для электролиза растворов.
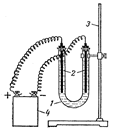
Рис. 9. Установка для электролиза растворов:
1 – электролизер;
2 – графитовые электроды;
3 – штатив;
4 – источник тока или выпрямитель.
 2015-04-01
2015-04-01 2588
2588
