| нормальных или средних |
| При взаимодействии: 1) металла с неметаллом Fe + S = FeS; 2) кислоты с металлом Zn + H2SO4 = ZnSO4 + Н2↑; 3) кислоты с основанием HCl + NaOH = NaCl + Н2О; 4) кислоты с основным оксидом 2 HCl + СuО = CuCl2 +Н2О; 5) кислотного оксида с основным оксидом SO3 + СuО = СuSO4; 6) кислотного оксида с основанием СO2 + Ca(ОН)2 = СаСО3 + Н2О; 7) кислоты с солью H2SO4 + BaCl2 = BaSO4↓ + 2 HCl; 8) щелочи с солью 2 NaOH + CuSО4 = Сu(ОН)2 ↓ +Na2SО4; 9) двух солей АgNО3 + NaCl = AgCl ↓ + NaNО3; 10) соли с металлом CuSO4 + Fe = FeSО4 + Сu↓. |
| основных |
| Только многокислотные основания дают основные соли. l) кислоты с избытком основания: HCl + Мg(ОН)2 = MgOHCl + Н2О; 2) нормальной соли с недостаточным количеством основания: Вi(NО3)3 + 2 NaOH = Вi(ОН)2NО3 + 2 NaNО3; CаCl2 + КОН = СаОНСl + KCl. |
| кислых |
| Только многоосновные кислоты дают кислые соли. l) при взаимодействии основания с избытком кислоты: NaOH + H2SО4 = NaНSO4 + Н2О; 2) при действии на нормальную соль избытка той же кислоты: ↓СаСО3 + СО2 + Н2О = Са(НСО3)2. |
| получение нормальных солей из кислых |
| При действии основания на кислую соль получаются нормальные соли: 2 СаНРО4 + Са(ОН)2 = Са3(РО4)2 + 2 Н2О. |
| получение нормальных солей из основных |
| Нормальные соли из основных получаются при действии кислоты на основную соль: MgOHCl + НСl = MgC12 + Н2О; FеОН(NО3)2 + НNО3 = Fе(NО3)3 + Н2O. |
| Комплексные соединения – определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии. | |||
| Комплексообразователь (центральный атом) –один из атомов, обычно положительно заряженный, занимающий центральное место в молекуле комплексного соединения. | |||
| Лиганды – противоположно заряженные ионы или нейтральные молекулы, расположенные вокруг комплексообразователя. | |||
| Координационное число центрального иона – общее число σ-связей, образуемых комплексообразователем с лигандами. | |||
| внутренняя сфера ион-комплексообразователь + лиганды = комплексный ион | внешняя сфера противоионы (катион или анион соли) | ||
Например: [Cu(NH3)4]Cl2 – хлорид тетраамин меди (II)
Образование комплексных соединений связано со способностью катионов металлов присоединять определенные молекулы и/или отрицательно заряженные ионы. Cu2++4NH3 = [Cu(NH3)4]2+ [Cu(NH3)4]2+ + 2Cl– = [Cu(NH3)4]Cl2 [ ] – комплексный ион – донорно-акцепторная связь, Cu2+ – комплексообразователь, NH3 – лиганды, 4 – координационное число (к/ч) [Cu(NH3)m]. Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов. |
| Ион | К/ч | Ион | К/ч |
| Al3+ | 4,6 | Ag+ | |
| Zn2+ | Hg+ | ||
| Fe2+ | 4,6 | Hg2+ | |
| Fe3+ | 4,6 | Cr3+ | 4,6 |
| Комплексные соединения могут относиться к различным классам: солям, основаниям, кислотам. Комплексные ионы могут быть как положительными, так и отрицательными, т.е. выступать в соединениях в виде катионов и в виде анионов, например: Na[Аu(CN)2] = Na+ + [Аu(CN)2]–; К2[HgI4] = 2К+ + [HgI4]2–; [Сu(NН3)4]SO4 = [Сu(NН3)4]2+ + SO42–. |
| Получение комплексных соединений |
| Один из способов получения комплексных соединений основан на введении в химическую систему избытка лигандов для создания соотношения, соответствующего координационному числу. На этом принципе основаны реакции растворения некоторых осадков, в т.ч. амфотерных гидроксидов в растворах щелочей. а) Zn(OH)2(осадок)+2KOH = K2[Zn(OH)4] Zn(OH)2+2OH– = [Zn(OH)4]2–; б) AlCl3+3KOH =↓Al(OH)3+3KCl Al(OH)3+KOH = K[Al(OH)4] или Al(OH)3+3KOH = K3[Al(OH)6] Al(OH)3 + 3ОН– = [Al(OH)6]3–; в) HgI2(осадок)+2KI = K2[HgI4] – тетрайодогидроаргат(II) калия HgI2+2I– = [HgI4]2–. |
| Другой из способов – взаимодействие металлов с водными растворами щелочей. Металлы, оксиды которых обладают амфотерными свойствами, взаимодействуют с водными растворами щелочей, образуя гидроксокомплексы. В этих реакциях окислителем является вода, из которой восстанавливается водород: Zn + 2H2O + 2KOH → K2[Zn(OH)4] + H2↑. |
| Химические свойства комплексных соединений |
| Комплексным соединениям присущи многие свойства обычных соединений. Например, реакции обмена с участием двух солей: 3FeCl2+2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+6KCl; 3Fe2++2[Fe(CN)6]3– = Fe3[Fe(CN)6]2. |
| Для комплексных соединений характерны специфические реакции, связанные с замещением одного лиганда другим. [Cu(H2O)4]SO4+4NH3=[Cu(NH3)4]SO4+4H2O; [Cu(H2O)4]2++4NH3=[Cu(NH3)4]2+ + 4H2O. Координационное число комплексного иона возрастает с увеличением силы лиганда. CN– > NO2– > NH3 > CNS– > H2O > OH– > CL– > Br– > I–. Лиганды, расположенные в левой части называют сильными, в правой – слабыми (относительно середины). |
В водных растворах комплексные соединения диссоциируют на комплексные ионы и ионы внешней сферы; [Сu(NН3)4]C12 ↔ [Сu(NН3)4]2+ + 2Cl–. Ионы внешней сферы присоединены к комплексному иону ионной связью. В незначительной степени комплексный ион тоже может диссоциировать:[Сu(NН3)4]2+ ↔ Сu2++ 4NН3. Константа равновесия данной системы определяет прочность комплексного иона и называется константа нестойкости: 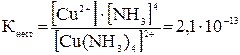 Чем больше Кнест, тем менее прочен комплексный ион. Чем больше Кнест, тем менее прочен комплексный ион. |
| Номенклатура комплексных соединений |
| В названии комплексных соединений отражается его состав справа налево, в названии комплексного иона (то, что в […]) последовательно перечисляется число лигандов, название лиганда, название иона-комплексообразователя, причем, для аниона используются латинская основа слова, а для катиона – русская. |
| Например: [Cu(NH3)4]2+ – ион тетрааминмеди (II); NH3 – амин; CN– – циано; [Ag(NH3)2]+ – ион диамин серебра; [Al(H2O)6]3+ – ион гексааква алюминия; [Al(OH)4]– – тетрагидроксоалюминат; [Cu(NH3)4](OH)2 – гидроксидтетраамин меди (II); H2[TiCl6] – гексахлортитановая кислота. |
 2015-04-01
2015-04-01 1066
1066









