Современные методы генетической инженерии уже позволили осуществить путём трансформации генов бактерий синтез ценных белков в промышленных количествах. В качестве примера можно указать на производство, с использованием методов генетической инженерии, физиологически активных белков – инсулина, интерферона и гормона роста (соматотропина). Список этих ценных препаратов сейчас расширяется. Синтез физиологически активных белков в микроорганизмах обходится ещё дорого, а промышленная технология ещё до конца не разработана. К тому же способности бактерий к синтезу белковых соединений ограничены. Например, бактерии не способны синтезировать комплексные соединения, в которых молекулы полипептидов связаны с молекулами сахаров.
Биологическая функция многих белков зависит от правильной переработки первичного продукта гена внутри клетки. Такая переработка охватывает, например, протеолитическое расщепление первичных продуктов генов или их гликолизирование. Преимущество сельскохозяйственных животных, по сравнению с бактериями или дрожжами, заключается в способности их клеток правильно перерабатывать желаемый продукт. Известно, что в наивысшую стадию лактации от высокопродуктивной коровы можно ежедневно получать около 1 кг протеина. Имеется возможность промотор коровьего белка казеина соединить со структурной частью желаемого гена ценного белка, например, инсулина или интерферона, а затем инъецировать рекомбинантную ДНК в зиготу или двухклеточный эмбрион. От трансгенных коров можно будет получать в большом количестве ценные белки и это откроет принципиально новое направление в селекции животных.
|
|
|
Получение инсулина.
Инсулин – гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний – сахарному диабету, который как причина смерти стоит на третьем месте после сердечно-сосудистых заболеваний и рака. Инсулин – небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочного предшественника – проинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35- звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
|
|
|
Известно несколько форм сахарного диабета. Самая тяжёлая форма, для лечения которой больному необходим инсулин (инсулинзависимая форма заболевания), вызвана избирательной гибелью клеток, синтезирующих этот гормон (клетки островков Лангерганса в поджелудочной железе). Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удаётся справляться с помощью соответствующих диет и режима.
Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800-1000 г исходного сырья.
Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены в 1963 и 1965 гг тремя коллективами исследователей в США, Китае и Германии. В 1980 г датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека путём замещения 30-го остатка аланина в цепи В на остаток треонина. Оба инсулина не различались по активности и длительности действия.
Работы по генно-инженерному получению инсулина начались около 30 лет назад. В 1978 году появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках E. Coli (рис. 8.32):
1.Каждый из полученных синтетических генов подстраивался к 3'-концу гена фермента в- галактозидазы и вводился в векторную плазмиду - pBR322 (1).
2. Клетки E. Coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные) белки, состоящие из фрагмента в- галактозидазы и А и В пептида инсулина, присоединённого к ней через остаток метионина (2).
3. После обработки химерного белка бромцианом и протеолитического отщепления С-пептида образуется инсулин.
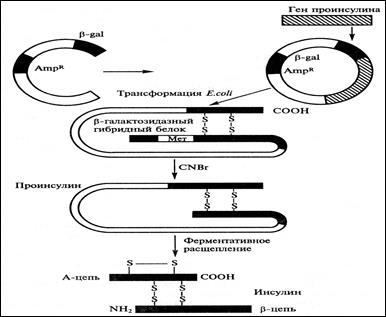
Рис. 8.32. Схема синтеза инсулина
Синтез соматотропина (гормона роста или ГР).
Соматотропин секретируется передней долей гипофиза. Впервые он был выделен (и очищен) в 1963 г из гипофиза. Его недостаток приводит к заболеванию – гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза забитых на мясокомбинате животных, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости и лишь в развитых странах. Основные производители – Швеция, Италия, Швейцария и США. Молекула ГР человека состоит из 191 аминокислотного остатка.
Препарат из гипофизов боенского материала представляет собой смесь из нескольких форм. Это приводило к тому, что у 30% больных получивших препарат против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
Принимая во внимание это обстоятельство, в настоящее время ГР синтезируют методами гинетической инженерии в специально сконструированных клетках бактерий. Будучи синтезированным в клетках E. Coli, ГР содержит дополнительный остаток метионина на H2N-конце молекулы. Биосинтез гормона роста из 191 аминокислотного остатка был впервые осуществлён в 1979 году Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путём расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей, со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 1000 000 молекул гормона на клетку.
|
|
|
Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г после многолетних клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального соматотропина.
ГР в клетках E. Coli и в культуре клеток животных был получен в 1984 году одновременно в институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГР, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и промышленный синтез полипептида, аналога гипоталамического релизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, таких, как карликовость (для увеличения живой массы и ускорения роста человека и животных), всех форм диабета, регенерации тканей после ожогов и др. Это происходит за счёт того что он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у человека и животных.
В селекции крупного рогатого скота перенос гена соматотропина позволяет, по оценке учёных: 1. Увеличить молочную продуктивность и живую массу животных; 2. Повысить содержание белка в молоке и мясе. Научный интерес к действию соматотропина на лактацию млекопитающих проявился ещё более 70 лет назад. Первые работы поизучению влияния соматотропина на молочную продуктивность коров были осуществлены в России ещё в 1937 г (Азимов Г., 1937). В этих исследованиях впервые было показано, что введение неочищенного экстракта из гипофиза приводит к повышению молочной продуктивности лактирующих коров на 8%. Однако сложность очистки этого гормона и весьма ограниченные возможности его производства не позволяли провести широкие исследования по изучению механизмов его действия на молочную продуктивность. И только позднее в экспериментах с использованием соматотропина крупного рогатого скота тонкой очистки было установлено, что ежедневное введение экзогенного гормона приводило к повышению надоев молока на 10-40%. Однако в этих опытах увеличение надоев молока отмечалось лишь в первые 14-16 дней (Banman D., Mc-Cutehon S., 1985).
|
|
|
Известно, что гормон роста, действуя на поверхностные рецепторы клетки, повышает в них синтез белка. Опыты по использованию соматотропина на молочных коровах показали, что, имеется тесная связь между действием гена этого гормона и продуктивностью. Фирма «Монсанто», которая разработала генно-инженерный способ синтеза гормона роста крупного рогатого скота доказала его эффективность (2002 г). При этом отмечается, что самый большой вклад в увеличение продуктивности может дать использование именно этого гормона. Предполагается, что в США к 2018 году этот гормон будут получать 50% коров. Наряду с усовершенствованными технологиями применение гормона позволит повысить средний удой молока от коровы к 2020 году до 9281кг и сократить число коров на 20%.
Получение интерферона.
Интерферон был открыт в 1957 году в Национальном институте медицинских исследований в Лондоне, как факторы устойчивости к вирусной инфекции. Было установлено, что клетки животных, подвергнутых воздействию вируса, выделяют в среду фактор, способный придавать свежим клеткам устойчивость к вирусной инфекции. Он препятствовал (интерферировал) размножению вирусов в клетке и, в силу этой способности, был назван интерфероном.
Известны три группы интерферонов:
1. α (альфа-интерфероны, α -И), образующиеся при воздействии вирусов на лейкоциты;
2. β (бета-интерфероны, β -И), появляющиеся при воздействии вирусов на фибробласты;
3. λ (гамма-интерфероны, λ -И), продуцируемые Т-лимфоцитами в ответ на воздействие бактериальными и вирусными антигенами или антисыворотками против поверхностных детерминант лимфоцитов.
Все интерфероны (кроме α -И) гликопротеины; они представляют собой типичные глобулярные белки, причём на долю а- спиральных структур приходится от 40 до 75%. В α -И обнаружены две дисульфидные связи. Интерфероны низкомолекулярные белки из 146 -166 аминокислотных остатков; видоспецифичны.
К числу наиболее хорошо исследованных интерферонов следует отнести α -интерфероны; число генов их кодирующих примерно 20. λ интерферон в отличие от гетерогенного класса α -интерферонов представлен всего одним индивидуальным белком, который кодируется одним геном. Менее ясна ситуация в отношении β- интерферонов. Выделен только один белок, соответствующий β- интерферону – интерферон β1; ему соответствует практически вся противовирусная активность, обнаруживаемая после индукции фибробластов. Не исключено, что в геноме существует ряд генов, кодирующих различные β- интерфероны. Интерфероны – это как бы первая линия обороны против инфекции.
Интерфероны широко используются для лечения различных тяжёлых заболеваний – острого вирусного гепатита, рассеянного склероза, остеосаркомы, миеломы, ряда опухолей гортани, лёгких и мозга.
С учётом видоспецифичности интерферонов, предназначенных для лечения, необходимы такие препараты, которые получены из клеток человека и животных. Традиционно их извлекают из крови человека и животных (из 1 л крови можно выделить всего 1 мкг интерферона, т. е. одну дозу для инъекции). До последнего времени бόльшая часть мирового производства интерферонов осуществлялась в Финляндии и Франции. С 1990 года одна из японских компаний наладила производство лимфобластоидного интерферона из лимфобластоидных клеток. С этой целью культура данных клеток индуцировалась вирусом Сендай, после чего интерферон выделяли с помощью хроматографических колонок, заполненных моноклональными антителами против получаемого интерферона. В Швеции лабробласты выращивали в ферментёрах объёмом 2000 л; полученные интерфероны очищали с помощью моноклональных антител.
Из всех видов интерферонов для мирового производства наиболее пригоден β- И. Фибробласты, получаемые из тканей плода, можно поддерживать в культуре клеток, что даёт возможность массового производства. Метод получения β- интерферона был разработан в Англии.
Выше перечисленные методы получения интерферонов характеризуются низким выходом, высокой стоимостью и недостаточной чистотой препарата. На современном этапе наиболее перспективный метод – биосинтез интерферонов с помощью генетически сконструированных микроорганизмов. Однако использование генно-инженерных технологий для получения интерферонов сопряжено с рядом трудностей. Они заключаются в том, что в смеси м-РНК, кодирующих различные белки, содержание кодирующих интерферон чрезвычайно мало – всего 0,1%. Тем не менее, ДНК, полученные обратным траскрибированием, были клонированы в E. Coli (рис. 8.33). Это явилось революционным событием в теоретических и прикладных исследованиях интерферонов. Метод состоит из следующих элементов:
1. Ген интерферона от человека встраивают в векторную ДНК; 2. Присоединяют к нему бактериальные регуляторные элементы, программирующие его транскрипцию и трансляцию в бактериальной клетке (рис. 8.33).
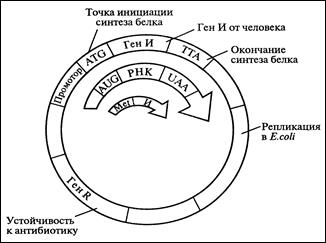
Рис. 8.33. Схема рекомбинантной плазмиды,
 2015-04-30
2015-04-30 3086
3086








