б) сохранения массы веществ
в) постоянства массы веществ
г) постоянства эквивалентов веществ
д) постоянства соотношения масс атомов в молекуле
22. Вещество А, получаемое в результате следующей схемы превращения:
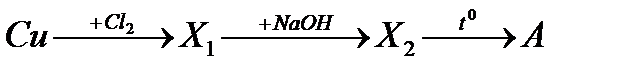
а) Cu
б) Cu(OH) 
в) CuO
г) CuCl 
д) Cu(OH)Cl
23. Вещество А, получаемое в результате следующей схемы превращения:
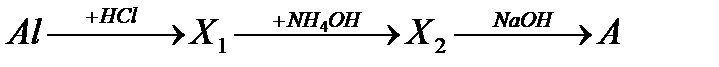
а) Al(OH) 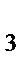
б) Al 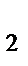 O
O 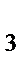
в) Al(ОH)Cl 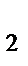
г) Na[Al(OH) 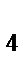 ]
]
д) [Al(NH 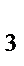 )
) 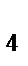 ]Cl
]Cl 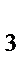
24. Сульфат натрия нельзя получить по реакции:
а) 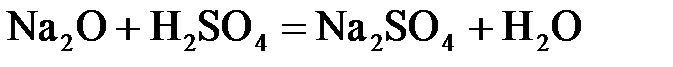
б) 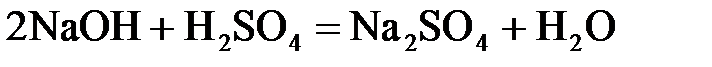
в) 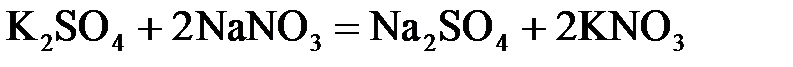
г) 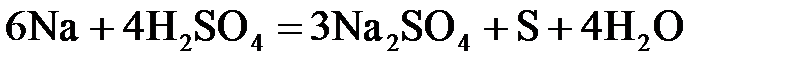
д) 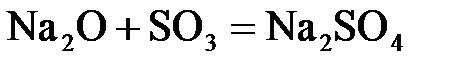
25. Основание, реагирующее и с кислотами и со щелочами с образованием соли и воды называется:
а) нерастворимым
б) щелочью
в) амфотерным
г) амфолитом
д) аморфным
26. Соль, как правило, не получают по реакции:
а) нейтрализации
б) обмена
в) замещения
г) соединения
д) разложения
27. Вещество, реагирующее с металлами, оксидами металлов, основаниями и солями, относится к классу:
а) кислот
б) простых веществ
в) амфотерных оснований
г) кислотных оксидов
д) основных оксидов
28. Вещество, реагирующее с неметаллами, кислотными оксидами, кислотами, солями, амфотерными гидроксидами, относится к классу:
а) кислот
б) нерастворимых оснований
в) щелочей
г) солей
д) оксидов
29. Вещество, реагирующее с водой, щелочами и основными оксидами относится к классу:
а) амфотерных оксидов
б) кислотных оксидов
в) кислот
г) солей
д) неметаллов
30. Вещество А, получаемое в результате схемы превращения:
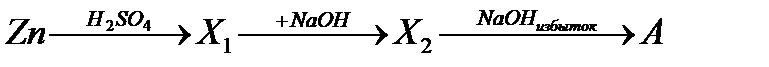
а) Zn(OH) 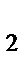
б) Na[Zn(OH) 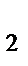 ]
]
в) Na 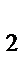 [Zn(OH)
[Zn(OH) 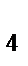 ]
]
г) ZnO
д) Zn
31. Соляная кислота не взаимодействует:
а) Zn
б) NaOH
в) AgNO 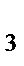
г) Cu
д) CaO
32. Нерастворимые в воде основания реагируют с:
а) солями
б) основными оксидами
в) кислотными оксидами
г) кислотами
д) амфотерными оксидами
33. Щелочные металлы реагируют с водой при этом образуется:
а) щелочь и вода
б) основной оксид и водород
в) нерастворимое основание и водород
г) растворимое основание и водород
д) соль и водород
34. С разбавленной серной кислотой не реагирует:
а) Zn
б) Al
в) Fe
г) Cr
д) Ag
35. С каким из перечисленных веществ не реагирует оксид натрия:
а) серная кислота
б) вода
в) оксид фосфора (+5)
г) оксид бария
д) оксид углерода (+4)
36. С каким из перечисленных веществ не реагирует раствор гидроксида натрия:
а) оксид серы (+4)
б) хлорид меди (+2)
в) гидроксид алюминия
г) оксид железа (+2)
д) азотная кислота
37. Главное квантовое число характеризует:
а) энергию энергетического уровня
б) энергию энергетического подуровня
в) энергию атомной орбитали
г) собственный механический момент движения электрона
д) положение атомной орбитали в пространстве
38. Магнитное квантовое число характеризует:
а) энергию энергетического уровня
б) энергию энергетического подуровня
в) энергию атомной орбитали в целом
г) собственный механический момент движения электрона
д) положение атомной орбитали в магнитном поле
39. Побочное или орбитальное квантовое число характеризует:
а) энергию энергетического уровня
б) энергию энергетического подуровня
в) энергию атомной орбитали в целом
г) собственный механический момент движения электрона
д) положение атомной орбитали в магнитном поле
40. Принцип неопределенности Гейзенберга:
а) невозможно одновременно определить массу и скорость микрочастицы
б) невозможно одновременно определить скорость и положение микрочастицы
в) невозможно одновременно определить массу и энергию микрочастицы
г) невозможно одновременно определить энергию и массу микрочастицы
д) масса и энергия микрочастицы имеют неопределенные значения
41. Если главное квантовое число равно 4, то орбитальное (побочное) квантовое число может принимать значение:
а) 1,2,3,4
б) 0,1,2,3
в) ±4,±3,±2,±1,0
г) +1/2, -1/2
д) +4, 0, -4
42. Если побочное (орбитальное) квантовое число равно 3, то магнитное  квантовое число может иметь значения:
квантовое число может иметь значения:
а) ±3
б) ±3, ±2, ±1, 0
в) 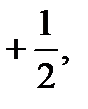
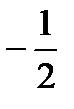
г) 0, 1, 2, 3
д) 0, 1, 2
43. Выберите из разновидностей атомов изотопы:
а) 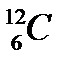 ,
, 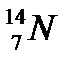 ,
, 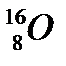
б) 
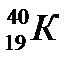 ,
, 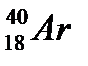 ,
, 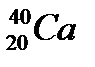
в) 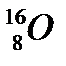 ,
, 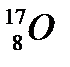 ,
, 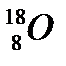
г) 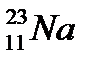 ,
, 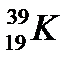 ,
, 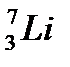
д) 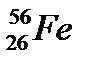 ,
, 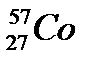 ,
, 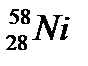
44. Выберите из разновидностей атомов изобары:
а) 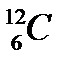 ,
, 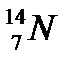 ,
, 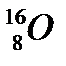
б) 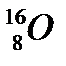 ,
, 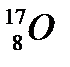 ,
, 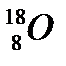
в) 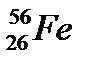 ,
, 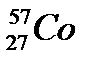 ,
, 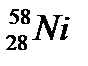
г) 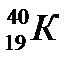 ,
, 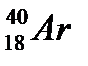 ,
, 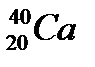
д) 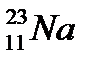 ,
, 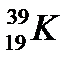 ,
, 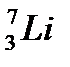
45. Количество протонов, нейтронов и электронов в изотопе 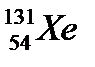 соответственно равно:
соответственно равно:
а) 54, 54, 77
б) 54, 131, 54
в) 131, 54, 77
г) 77, 77, 54
д) 54, 77, 54
46. Количество протонов, нейтронов и электронов в изотопе 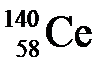 соответственно равно:
соответственно равно:
а) 58, 58, 82
б) 58, 140, 58
в) 58, 82, 58
г) 82, 82, 58
д) 82, 58, 82
47. Количество протонов, электронов и нейтронов в изотопе 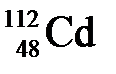 соответственно равно:
соответственно равно:
а) 48, 48, 64
б) 48, 112, 48
в) 48, 64, 48
г) 64, 64, 48
д) 112, 48, 112
48. Для 3d-подуровня главное и побочное (орбитальное) квантовые числа равны:
а) 2 и 3
б) 3 и 2
в) 3 и 1
г) 3 и 0
д) 2 и 0
49. Электронная формула иона 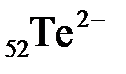 :
:
а) 1s22s22p63s23p64s23d104p65s24d105p6
б) 1s22s22p63s23p64s23d104p65s24d85p8
в) 1s22s22p63s23p64s23d104p65s24d105p2
г) 1s22s22p63s23p64s23d84p65s24d85p6
д) 1s22s22p63s23p64s23d104p65s24d105p4
50. Для 4f-подуровня главное и побочное (орбитальное) квантовые числа равны:
а) 4 и 3
б) 3 и 4
в) 4 и 1
г) 4 и 2
д) 2 и 4
51. Максимальное число электронов, расположенных на s, p, d и f подуровнях соответственно равна:
а) 1, 3, 5, 7
б) 2, 6, 10, 14
в) 2, 10, 14, 6
г) 2, 4, 6, 8
д) 2, 8, 12, 16
52. Какова электронная структура третьего и четвёртого уровней у атома титана в нормальном состоянии:
а) 3s23p64s13d24p1
б) 3s23p64s23d2
в) 3s23p64s24p23d0
г) 3s23p64s13d3
д) 3s13p54s13d5
53. Электронная формула иона 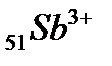
а) 1s22s22p63s23p64s23d104p65s24d105p3
б) 1s22s22p63s23p64s23d104p65s24d105p0
в) 1s22s22p63s23p64s23d104p65s24d105p6
г) 1s22s22p63s23p64s23d84p65s24d85p4
д) 1s22s22p63s23p64s23d84p65s24d105p6
54. Электронная формула иона 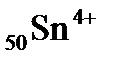
а) 1s22s22p63s23p64s23d104p65s24d105p2
б) 1s22s22p63s23p64s23d104p65s24d85p0
в) 1s22s22p63s23p64s23d104p65s04d105p0
г) 1s22s22p63s23p64s23d84p65s24d85p6
д) 1s22s22p63s23p64s23d104p65s24d105p6
55. Выберите в соответствии с принципом Гунда распределение 7 электронов на 4f-подуровне:
| ¯ | | | | | |
а)
| ¯ | ¯ | | | |
б)
| ¯ | ¯ | ¯ | |
в)
| | | | | | | |
г)
| | | ¯ | ¯ | |
д)
56. Свойства элементов и их соединений в периодической таблице повторяются так как:
а) постоянно увеличивается масса атома
б) постоянно увеличивается заряд ядра атома
в) периодически повторяется количество электронов на внешнем энергетическом уровне
г) постоянно увеличивается количество электронов на внешнем уровне
д) периодически повторяется количество нейтронов в ядре атома
57. Энергия ионизации с увеличением порядкового номера в периодах:
а) увеличивается
б) не изменяется
в) уменьшается
г) не имеет выраженной тенденции как к увеличению значения, так и к уменьшению
д) колеблется около одного значения
58. Атомная орбиталь- это:
а) траектория движения электрона
б) область пространства, вероятность нахождения электрона в которой, составляет 95%
в) радиус атома
г)область пространства вероятность нахождения электрона в которой составляет 5%
д) область пространства вероятность нахождения электрона в которой составляет 50%
59. Энергия сродства к электрону – это:
а) энергия, необходимая для удаления 1 моля электронов от 1 моля атомов
б) энергетический эффект присоединения 1 моля электронов к 1 молю нейтральных атомов
в) способность атомов в соединениях притягивать к себе электроны, выраженная в кДж
г) энергетическая способность электрона
д) энергетическая способность атома взаимодействовать с электонами
60. К внутримолекулярным химическим связям не относится:
а) ковалентная неполярная связь
б) ионная связь
в) металлическая связь
г) ковалентная полярная связь
д) ориентационное взаимодействие
61. К межмолекулярному взаимодействию не относится:
а) водородная связь
б) индукционное взаимодействие
в) ковалентная связь
г) дисперсионное взаимодействие
д) ориентационное взаимодействие
62. При образовании химической связи происходит процесс смешения атомных орбиталей разных по форме и энергии и выравнивание их по форме и энергии. Этот процесс называется:
а) сублимация
б) гибридизация
в) форматизация
г) метаморфоза
д) парадокс
63. Тип гибридизации и форма молекулы 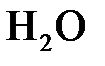 :
:
а) sp  2, угловая
2, угловая
б) sp  , угловая
, угловая
в) sp 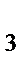 , тетраэдрическая
, тетраэдрическая
г) sp 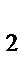 , треугольная
, треугольная
д) нет гибридизации, угловая
64. Тип гибридизации и форма молекулы BCl 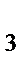 :
:
а) sp 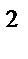 , угловая
, угловая
б) sp 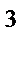 , угловая
, угловая
в) sp 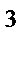 , тетраэдрическая
, тетраэдрическая
г) sp 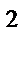 , треугольная
, треугольная
д) нет гибридизации, угловая
65. Тип гибридизации и форма молекулы СН 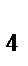 :
:
а) sp 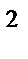 , угловая
, угловая
б) sp 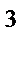 , угловая
, угловая
в) sp 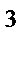 , тетраэдрическая
, тетраэдрическая
г) sp 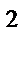 , треугольная
, треугольная
д) sp 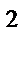 d, тераэдрическая
d, тераэдрическая
66. Выберите последовательность, в которой все частицы насыщены:
а) BeH 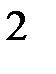 , B
, B 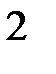 H
H 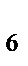 , NH
, NH 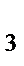
б) NH 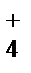 , CH
, CH 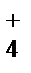 , BH
, BH 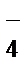
в) C 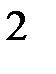 H
H 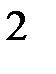 , C
, C 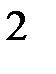 H
H 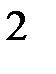 , C
, C 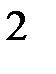 H
H 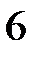
г) Cl 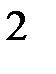 , PH
, PH 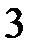 , H
, H 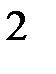 O
O
д) C 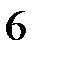 H
H 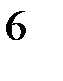 , PH
, PH 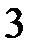 , SiH
, SiH 
67. Исключите свойство, характеризующее не только ковалентную связь:
а) направленность
б) насыщаемость
в) кратность
г) полярность
д) энергия связи
68. Способность атома в соединении оттягивать на себя общие электронные пары – это:
а) электроотрицательность
б) энергия сродства к электрону
в) энергия ионизации
г) валентность
д) ковалентность
69. Расположите молекулы H2, HBr, HF, HCl в порядке уменьшения полярности связи:
а) HF, HCl, HBr, H 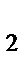
б) H 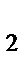 , HBr, HCl, HF
, HBr, HCl, HF
в) HBr, HCl, HF, H 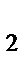
г) HCl, H 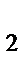 , HF, HBr
, HF, HBr
д) HF, HBr, H 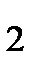 , HCl
, HCl
70. Выберите ряд в котором все атомы образуют друг с другом ионную связь:
а) HF, KF, F 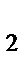
б) NaCl, KCl, RbCl
в) HCl, NaCl  , H
, H 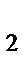 O
O
г) CaO, CaCl 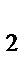 , HCl
, HCl
д) NH 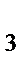 , N
, N 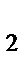 ,
, 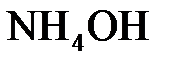
71. Ковалентная связь может образоваться:
а) по обменному и донорно-акцепторному взаимодействию
б) за счет электростатического притяжения
в) за счет совокупности свободных электронов
г) по ориентационному и индукционному взаимодействию
д) по дисперсионному взаимодействию
72. Полярность молекулы зависит:
а) от электроотрицательности атомов
б) от геометрии молекулы
в) от величины дипольного момента отдельных связей
г) как от электроотрицательности атомов, образующих связь, так и от пространственного расположения связей
д) от направления дипольного момента молекулы
73. Если валентный угол между связями составляет 109 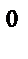 28' то у центрального атома тип гибридизации:
28' то у центрального атома тип гибридизации:
а) sp
б) sp 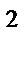
в) sp 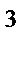
г) sp 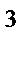 d
d
д) sp 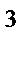 d
d 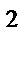
74. Если валентный угол между связями составляет 120 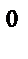 , то у центрального атома тип гибридизации:
, то у центрального атома тип гибридизации:
а) sp
б) sp 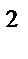
в) sp 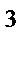
г) sp 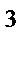 d
d
д) sp 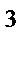 d
d 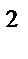
75. Определите кратность химической связи в частице 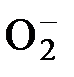 и ее магнитные свойства согласно методу ЛКАО метода молекулярных орбиталей:
и ее магнитные свойства согласно методу ЛКАО метода молекулярных орбиталей:
а) 2, диамагнитна
б) 1, парамагнитна
в) 3/2, диамагнитна
г) 3/2, парамагнитна
д) такая частица существовать не может
76. Положение, не соответствующее методу МО как ЛКАО:
а) из двух атомных орбиталей образуется две молекулярные орбитали
б) электроны заполняют молекулярные орбитали в соответствии принципом наименьшей энергии, принципом Паули и правилом Гунда
в) порядок связи определяется по разности числа электронов на связывающих и разрыхляющих атомных орбиталях деленной на два
г) по наличию неспаренных электронов можно определить магнитные свойства молекулы
д) молекулярные орбитали могут образовывать атомные орбитали, обладающие любыми значениями энергии и симметрией
77. Кратность связи в молекуле азота:
а) 1
б) 2
в) 3
г) 1/2
д) 3/2
78. Теория комплексных соединений впервые была разработана
а) А. Вернером
б) А. Бутлеровым
в) М. Каблуковым
г) М. Фарадеем
д) М. Ломоносовым
79. Комплексное соединение Na[Al(OH) 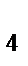 ] называется:
] называется:
а) гидроксид натрия-алюминия
б) гидроксоалюминат (+3) натрия
в) тетрагидроксоалюминат натрия
г) натрия тетрагидроксоалюминий
д) натрия тетрагидроксидалюминия
80. Комплексное соединение [Cu(NH 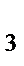 )
) 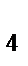 ]SO
]SO 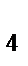 называется:
называется:
а) сульфат тетрааминмеди (I)
б) сульфат тетрааминмеди (II)
в) сульфат тетрааммиакмеди (II)
г) сульфат аммиаката меди (II)
д) тетрааминокупрат (II) серной кислоты
81. К нейтральным комплексным соединениям относится:
а) Сu[(NH 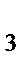 )
) 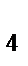 ]SO
]SO 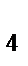
б) K 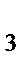 [Fe(CN)
[Fe(CN) 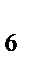 ]
]
в) K 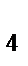 [Fe(CN)
[Fe(CN) 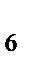 ]
]
г) [Ni(CO) 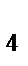 ]
]
д) H 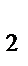 [PtCI
[PtCI 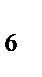 ].
].
82. К катионным комплексам относится:
а) K 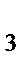 [Fe(CN)
[Fe(CN) 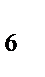 ]
]
б) (NH 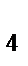 )
) 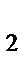 [PtCI
[PtCI 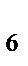 ]
]
в) [Cu(NH 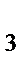 )
) 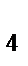 ]SO
]SO 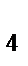
г) [Cr(H 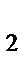 O)F
O)F 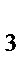 ]
]
д) [Сo(NO 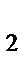 )CI(NH
)CI(NH 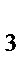 )
) 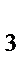 ].
].
83. К анионным комплексам относится:
а) H 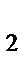 [PtCI
[PtCI 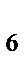 ]
]
б) [Ag(NH 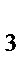 )
) 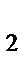 ]CI
]CI
в) К 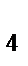 [Fe(CN)
[Fe(CN) 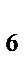 ]
]
г) [Ni(CO) 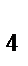 ]
]
д) [Cr(NH 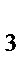 )
) 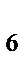 ]CI
]CI 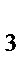
84. В комплексном соединении K 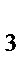 [Fe(CN)
[Fe(CN) 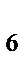 ] ионом комплексообразователем является:
] ионом комплексообразователем является:
а) K 
б) Fe 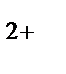
в) Fe 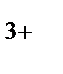
г) CN 
д) C 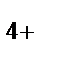
85. Структурный элемент комплексного соединения K 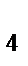 [Fe(CN)
[Fe(CN) 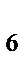 ] названный неверно:
] названный неверно:
а) K 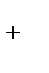 - ионы внешней сферы
- ионы внешней сферы
б) 6 - число лигандов
в) CN 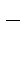 - лиганды или адденты
- лиганды или адденты
г) Fe 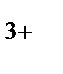 - ион комплексообразователь
- ион комплексообразователь
д) K 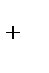 , Fe
, Fe 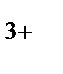 - ионы внутренней сферы
- ионы внутренней сферы
86. заряд иона комплексообразователя в комплексном соединении Na 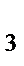 [Co(NO
[Co(NO 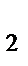 )
) 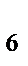 ] равен:
] равен:
а) +1
б) -1
в) +2
г) +3
д) -2
87. Чему равен заряд комплексообразователя в ионе [Co(NH 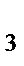 )
) 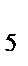 Cl]
Cl] 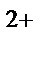
a) +2
б) +3
в) +1
г) +6
д) +5
88. Связь между внешней и внутренней координационными сферами:
а) ковалентная неполярная
б) ковалентная полярная
в) водородная
г) металлическая
д) ионная
89. Связь между комплексообразователем и лигандами:
а) ионная
б) ковалентная
в) водородная
г) металлическая
д) дисперсионная
90. В состав комплексного соединения входят: Co 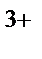 , 5NH
, 5NH 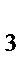 , 3Cl
, 3Cl 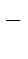 . На взаимодействие 1 моль комплексного соединения требуется 2 моль нитрата серебра. Выберите структуру комплексного соединения:
. На взаимодействие 1 моль комплексного соединения требуется 2 моль нитрата серебра. Выберите структуру комплексного соединения:
а) [Co(NH 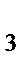 )
) 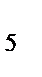 Cl
Cl 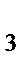 ]
]
б) [Co(NH 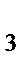 )
) 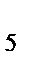 Cl]Cl
Cl]Cl 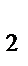
в) [Co(NH 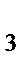 )
) 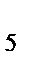 Cl
Cl 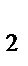 ]Cl
]Cl
г) [Co(NH 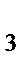 )
) 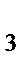 Cl
Cl 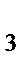 ](NH
](NH 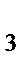 )
) 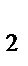
д) [Co(NH 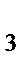 )
) 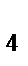 Cl
Cl  ]Cl(NH
]Cl(NH  )
)
91. При взаимодействии хлорида железа (III) и желтой кровяной соли K4[Fe(CN) 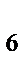 ] выпадает осадок синего цвета берлинской лазури. Формула берлинской лазури:
] выпадает осадок синего цвета берлинской лазури. Формула берлинской лазури:
а) Fe[Fe(CN) 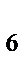 ]
]
б) Fe 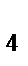 [Fe(CN)
[Fe(CN) 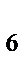 ]
]
в) Fe 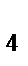 [Fe(CN)
[Fe(CN) 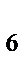 ]
] 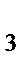
г) [Fe(CN) 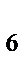 ]Cl
]Cl
д) [Fe(CN) 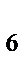 ]Cl
]Cl 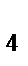
92. При взаимодействии хлорида железа (II) и гексацианоферрата(+3) калия образуется осадок синего цвета. Формула вещества выпавшего в осадок:
а) KCl
б) Fe 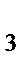 [Fe(CN)
[Fe(CN) 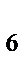 ]
]
в) Fe 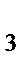 [Fe(CN)
[Fe(CN) 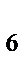 ]
] 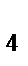
г) Fe 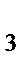 [Fe(CN)
[Fe(CN) 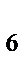 ]
] 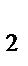
д) [Fe(CN) 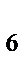 ]Сl
]Сl 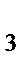
93. Формула соединения, образующаяся при взаимодействии хлорида хрома (III) с избытком гидроксида натрия:
а) Cr(OH) 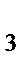
б) Na 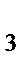 [Cr(OH)
[Cr(OH) 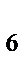 ]
]
в) Na 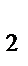 [Cr(OH)
[Cr(OH) 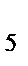 ]
]
г) Cr(OH) 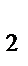 Cl
Cl
д) Cr(OH)Cl 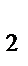
94. Константа нестойкости для комплексного иона [Cu(NH 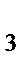 )
) 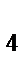 ]
] 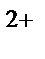 определяется по формуле:
определяется по формуле:
а) 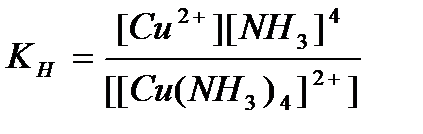
б) 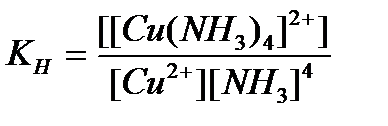
в) 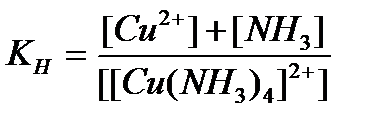
г) 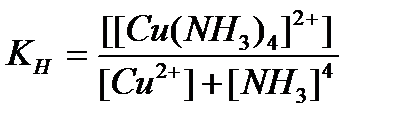
д) 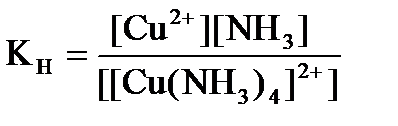
95. Константа устойчивости для комплексного иона [Fe(SCN) 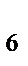 ]
] 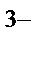 определяется по формуле:
определяется по формуле:
а) 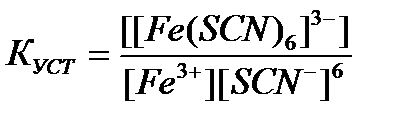
б) 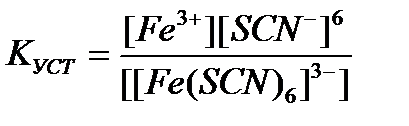
в) 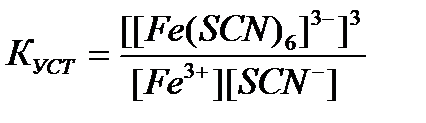
г) 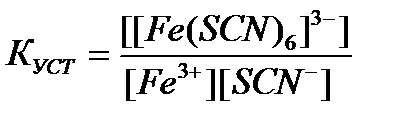
д) 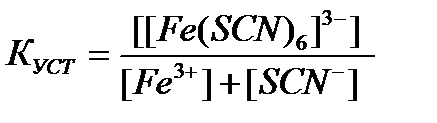
96. Константа нестойкости и устойчивости комплексного иона связана между собой соотношением:
а) К  = К
= К 
б) К  х К
х К  = 5
= 5
в) К  =
= 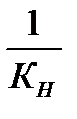
г) К 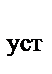 = - К
= - К 
д) К  = - lgК
= - lgК 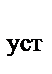
97. Наиболее устойчивое комплексное соединение с константой нестойкости равной:
а) 1·10 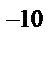
б) 3·10 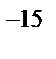
в) 5·10 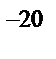
г) 6·10 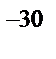
д) 6·10 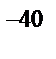
98. Комплексные соединения – это соединения в которых есть хотя бы одна химическая связь образованная:
а) за счет электростатического притяжения
б) по обменному механизму
в) по донорно-акцепторному механизму
г) за счет сильного взаимодействия
д) за счет гравитационного взаимодействия
99. Выберите соединения, которые являются только окислителями:
а) KMnO 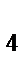 , K
, K 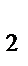 Cr
Cr 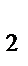 O
O 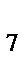 , H
, H 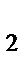 SO
SO 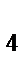
б) NH 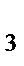 , H
, H  S, H
S, H  O
O
в) KMnO 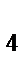 , MnO
, MnO  , MnCl
, MnCl 
г) HNO 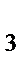 , NO
, NO  , NH
, NH 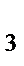
д) S, SO  , H
, H  SO
SO 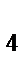
100. Из перечисленных соединений KMnO 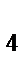 , K
, K  Cr
Cr  O
O 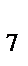 , H
, H  S, S, NH
S, S, NH 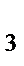 , H
, H  SO
SO 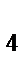
выберите те, которые являются только восстановителями в реакциях:
а) все
б) KMnO 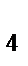 , K
, K  Cr
Cr  O
O 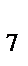 , H
, H  SO
SO 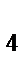
в) NH 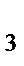 , H
, H  S
S
г) KMnO 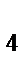 , K
, K  Cr
Cr  O
O 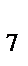 , S
, S
д) H  S, S, NH
S, S, NH 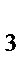
101. В зависимости от кислотности среды перманганат калия может восстанавливаться до:
а) Mn 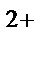 в кислой, MnO
в кислой, MnO  в нейтральной, MnO
в нейтральной, MnO 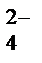 в щелочной
в щелочной
б) Mn 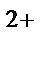 в щелочной, MnO
в щелочной, MnO  в нейтральной, MnO
в нейтральной, MnO 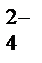 в кислой
в кислой
в) Mn 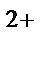 в нейтральной, MnO
в нейтральной, MnO  в щелочной, MnO
в щелочной, MnO 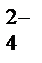 в кислой
в кислой
г) Mn 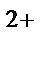 в кислой, MnO
в кислой, MnO  в щелочной, MnO
в щелочной, MnO 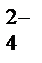 в нейтральной
в нейтральной
д) Mn 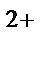 в щелочной, MnO
в щелочной, MnO  в кислой, MnO
в кислой, MnO 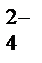 в нейтральной
в нейтральной
102. Сумма коэффициентов в уравнении реакции:
Cu + HNO 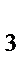 = Cu(NO
= Cu(NO 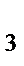 )
)  + NO + H
+ NO + H  O
O
а) 15
б) 16
в) 19
г) 20
д) 22
103. Сумма коэффициентов в уравнении реакции:
KMnO 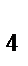 + Na
+ Na  SO
SO 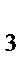 + H
+ H  SO
SO 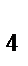 = MnSO
= MnSO 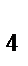 + Na
+ Na  SO
SO 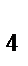 + K
+ K  SO
SO 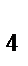 + H
+ H  O
O
а) 20
б) 21
в) 17
г) 19
д) 23
104. Сумма коэффициентов в уравнении реакции:
KMnO 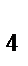 + Na
+ Na  SO
SO 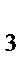 + H
+ H 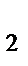 O = MnO
O = MnO  + Na
+ Na  SO
SO 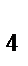 + KOH
+ KOH
а) 13
б) 21
в) 20
г) 17
д) 15
105. Сумма коэффициентов в уравнении реакции:
KMnO 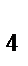 + Na
+ Na  SO
SO 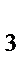 + КОН = К
+ КОН = К  МnO
МnO 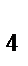 + Na
+ Na  SO
SO 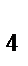 + H
+ H  O
O
а) 13
б) 21
в) 5
г) 9
д) 4
106. Окислителем в окислительно-восстановительном процессе HCl+CrO 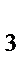 =Cl
=Cl  +CrCl
+CrCl 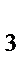 +H
+H  O является:
O является:
а) ион водорода
б) ион хлора
в) ион хрома(+3)
г) ион хрома(+6)
д) атом хлора
107. Восстановителем в окислительно-восстановительном процессе P+HNO 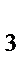 +H
+H  O=H
O=H 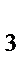 PO
PO 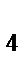 +NO является:
+NO является:
а) атом фосфора
б) ион водорода
в) ион азота(+5)
г) ион фосфора(+5)
д) ион азота(+2)
108. Окислительно-восстановительные реакции – это реакции, в которых происходит:
а) изменение степени окисления элементов
б) отдача электронов одним из элементов
в) присоединение электронов одним из элементов
г) разложение вещества при нагревании
д) обмен составных частей сложных веществ
109. Степень окисления элемента – это
а) условный формальный заряд атома в молекуле, рассчитанный из предположения, что молекула нейтральна и состоит из ионов
б) количество электронов на внешнем энергетическом уровне
в) количество отданных электронов
г) количество принятых электронов
д) количество отданных или принятых электронов
110. Из перечисленных соединений выберете те, которые в зависимости от условий могут проявлять как окислительные свойства, так и восстановительные S, SO  , H
, H  SO
SO 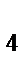 , NH
, NH 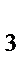 , HNO
, HNO 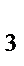 , NaNO
, NaNO  :
:
а) NH 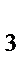 , HNO
, HNO 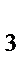 , NaNO
, NaNO 
б) SO  , H
, H  SO
SO 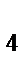 , NH
, NH 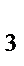
в) S, SO  , H
, H  SO
SO 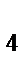
г) S, SO  , NaNO
, NaNO 
д) H  SO
SO 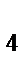 , NH
, NH 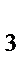 , HNO
, HNO 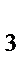 , NaNO
, NaNO 
111. Уравнения химических реакций, в которых указывается тепловой эффект, называются:
а) кинетическими
б) химическими
в) тепловыми
г) термохимическими
д) термодинамическими
112. Рассчитать тепловой эффект реакции С + 1/2О  ® СО + Q, если известны термохимические уравнения реакций:
® СО + Q, если известны термохимические уравнения реакций:
С + О  ® СО
® СО  + 393,5 кДж
+ 393,5 кДж
СО + 1/2О  ®СО
®СО  + 283,0 кДж
+ 283,0 кДж
а) 110.5 кДж
б) –110,5 кДж
в) 676,5 кДж
г) –676,5 кДж
д) 503,5 кДж
113. Используя закон Гесса, рассчитать тепловой эффект перехода алмаза в графит, если известны термохимические уравнения реакций горения алмаза и графита
С 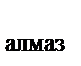 + О
+ О  ® СО
® СО  + 395,4 кДж
+ 395,4 кДж
С 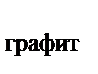 + О
+ О  ® СО
® СО  + 393,5 кДж
+ 393,5 кДж
С 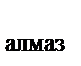 ® С
® С 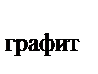 + Q
+ Q
Q равен:
а) – 1,9 кДж
б) + 1,9 кДж
в) 788,9 кДж
г) –788,9 кДж
д) +3,8 кДж
114. Используя закон Гесса, рассчитать тепловой эффект перехода угля в графит, если известны термохимические уравнения реакций горения угля и графита
С 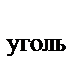 + О
+ О  ® СО
® СО  + 409,2 кДж
+ 409,2 кДж
С 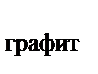 + О
+ О  ® СО
® СО  + 393,5 кДж
+ 393,5 кДж
С 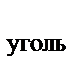 ® С
® С 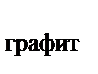 + Q
+ Q
Q равен:
а) +15,7 кДж
б) –15,7 кДж
в) +802,7 кДж
г) –802,7 кДж
д) +31,4 кДж
115. Используя следствие из закона Гесса, рассчитать тепловой эффект реакции 2Fe + 3H  O ® Fe
O ® Fe  O
O  + 3H
+ 3H  + Q, если известно, что тепловой эффект образования воды и тепловой эффект образования оксида железа (+3) соответственно равны 241,82 кДж/моль и 822,2 кДж/моль:
+ Q, если известно, что тепловой эффект образования воды и тепловой эффект образования оксида железа (+3) соответственно равны 241,82 кДж/моль и 822,2 кДж/моль:
а) +96,74 кДж
б) –96,74 кДж
в) 580,38 кДж
г) –580,38 кДж
д) 193,48 кДж
116. Реакция горения этана выражается термохимическим уравнением
С  Н
Н 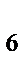 (Г)+3,5О
(Г)+3,5О  (Г)=2СО
(Г)=2СО  (Г)+3Н
(Г)+3Н  О(Ж).
О(Ж).
Вычислите энтальпию химической реакции, если известно, что
ΔН 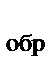 (СН6)=-84,67 кДж/моль, ΔНобр(СО
(СН6)=-84,67 кДж/моль, ΔНобр(СО  )=-393,51 кДж/моль,
)=-393,51 кДж/моль,
ΔН 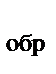 (Н
(Н  О)=-285,84 кДж/моль:
О)=-285,84 кДж/моль:
а) -1559,87 кДж
б) -1440,05 кДж
в) -397,06 кДж
г) -1120,00 кДж
д) -1780,01 кДж
117. Реакция горения аммиака выражается термохимическим уравнением
2NH 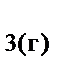 +2.5O
+2.5O 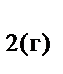 =2NO
=2NO 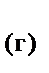 +3H
+3H  O
O 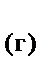 .
.
Вычислите энтальпию химической реакции в расчете на 1 моль NH3, если известно, что ΔН 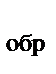 (NH
(NH 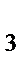 )=-46,19 кДж/моль, ΔН
)=-46,19 кДж/моль, ΔН 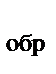 (NO)=+90,37 кДж/моль,
(NO)=+90,37 кДж/моль,
ΔН 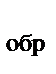 (H
(H  O)=-241,83 кДж/моль:
O)=-241,83 кДж/моль:
а) -226,185 кДж
б) -452,370 кДж
в) -904, 740 кДж
г) -1120,00 кДж
д)-113,092 кДж
118. Согласно следствию из закона Гесса тепловой эффект реакции равен:
а) разности между суммой теплот образования исходных веществ и продуктов реакции
б) разности между суммой теплот образования продуктов и исходных веществ
в) разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов
г) разности между суммой теплот образования исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов
д) рассчитать нельзя, нужно использовать закон Лавуазье-Лапласа
119. Термохимия – это раздел химии, который изучает:
а) тепловые эффекты химических реакций
б) тепловые эффекты фазовых переходов
в) зависимость давления газообразных веществ от температуры
г) условия, влияющие на скорость химических реакций
д) условия, влияющие на смещение химического равновесия
120. Тепловой эффект реакции образования – это:
а) тепло, которое выделяется в ходе химической
 2015-04-30
2015-04-30 1284
1284