Исходные данные:
Годовая производительность по ацетальдегиду, (Пгод), т/год По варианту
Годовой фонд рабочего времени, (Тэф), ч: По варианту
Состав технического этилена %масс:
-этилен По варианту
-этан По варианту
Степень конверсии этилена (Х),%: По варианту
Доля этилена, расходуемого на образование
продуктов окисления, %:
-ацетальдегид (S) По варианту
-уксусная кислота (ωэт на укс к-ту) По варианту
-кротоновый альдегид (ωэт на крот альд) По варианту
-диоксид углерода (ωэт на СО2) По варианту
-щавелевая кислота (ωэт на щав к-ту) По варианту
-высокомолекулярные и полимерные продукты(ωэт на ВМС) По варианту
-этилхлорид (ωэт на С2Н5СI) По варианту
-монохлорацетальдегид (ωэт на СIСН2СНО) По варианту
-дихлорацетальдегид (ωэт на СI2СНСНО) По варианту
-трихлорацетальдегид(ωэт на СI3ССНО) По варианту
-трихлорметан (ωэт на С2Н5СI СНСI3) По варианту
-дихлорметан (ωэт на СН2СI2) По варианту
Потери, %:
-ацетальдегид на стадии ректификации (ω потерь рект) По варианту
- этилена на стадии синтеза (ω потерь синтеза) По варианту
Объемная доля кислорода в отработанном воздухе По варианту
На 1 тонну ацетальдегида приходится фузельной воды, т. По варианту
Расход конденсата на 1 тонну ацетальдегида, т. По варианту
Плотность катализаторного раствора, кг/м3 (ρкат. р-ра) По варианту
Состав катализаторного раствора, % масс:
- PdCl2 По варианту
-CuCl2 По варианту
-CН3СООН По варианту
-НСl По варианту
-Н2О По варианту
Состав воздуха, % об
- кислород 20,9
- азот 79,1
Количество воздуха, поданного на окисление, % масс (ωвоздуха на окисл) 99,2
Состав фузельной воды, % масс
-Н2О По варианту
-СН3СНО По варианту
-СН3СООН По варианту
Расход активированного катализаторного раствора
на 1 тонну ацетальдегида, кг/ч (Ракт кат-ра) 1,85
Схема материальных потоков
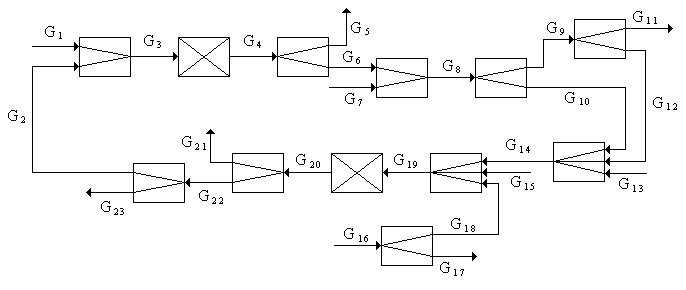
G1 – количество технического этилена, кг/ч,
G2 –количество циркулирующего катализаторного раствора, кг/ч,
G3 – количество исходной смеси, кг/ч,
G4 –количество реакционной смеси, кг/ч,
G5 –количество потерь этилена, кг/ч,
G6 –количество реакционной массы без потерь, кг/ч,
G7 -количество фузельной воды, кг/ч,
G8 –количество исходной смеси, кг/ч,
G9 – количество пара ацетальдегида и воды из верха колонны К 1, кг/ч,
G10 –количество катализаторного раствора из куба колонны К 1, кг/ч,
G11 –количество ацетальдегида и хлорорганика на ректификацию, кг/ч,
G12 –количество воды, кг/ч,
G13 – количество парового конденсата, кг/ч,
G14 –количество исходной смеси, кг/ч,
G15 -количество активированного катализаторного раствора, кг/ч,
G16 -количество воздуха, кг/ч,
G17- количество воздуха на активацию,кг/ч,
G18 - количество воздуха на окисление, кг/ч,
G19 –количество исходной смеси, кг/ч,
G20 –количество реакционной массы, кг/ч,
G21 - количество отработанного воздуха, кг/ч,
G22 –количество катализаторного раствора из сепаратора С 2, кг/ч,
G23 – количество катализаторного раствора на активацию, кг/ч.
Уравнение материального баланса G1 + G2 + G7 + G13 + G15 + G16 = G2 + G5 + G11 + G17 + G21 + G23
1 Рассчитать часовую производительность установки по ацетальдегиду:
П час=(П год∙1000) /Тэф (1)
где Пгод –производительность в год, кг/ч,
Тэф -время эффективное, ч.
П час= кг/ч
2 Рассчитать ацетальдегид с учетом потерь на стадии ректификации:
П час кг/ч - 100%
G потерь рект,кг/ч – ω потерь рект,%
G потерь рект,= П час ∙ ω потерь рект/100 = кг/ч, тогда
G ацетальдегида с уч.потерь = П час + G потерь рект = кг/ч
3 Рассчитать массу этилена:
G этилена= (G ацетальдегида с уч.потерь / М ацетальдегида)∙ Мэтилена (2)
где: М ацетальдегида, Мэтилена – молярные массы ацетальдегида и этилена, соответственно, г/моль.
G этилена= кг/ч
4 Рассчитать этилен с учетом селективности:
G этилена, кг/ч – S, %
Gэтилена с уч. селективности, кг/ч – 100%
Gэтилена с уч. селективности =(G этилена ∙100) / S = кг/ч
5 Рассчитать расход этилена с учетом конверсии:
Gэтилена с уч. селективности, кг/ч – Х,%
Gэтилена с уч. конверсии, кг/ч – 100%
Gэтилена с уч. конверсии =(Gэтилена с уч. селективности ∙ 100)/ Х = кг/ч
6 Рассчитать количество этилена, не вступившего в реакцию:
Gэтилена с уч. конверсии - G этилена с уч. селективности = G этилена невступившего в р -цию
G этилена невступившего в р -цию = кг/ч
7 Рассчитать количество этилена с учетом потерь на стадии синтеза:
Gэтилена с уч. конверсии, (п 5) кг/ч – 100%
G потерь синтеза, кг/ч – ω потерь синтеза, %
G потерь синтеза (поток G5)= Gэтилена с уч. конверсии, (п 5)∙ ω потерь синтеза/100 = кг/ч, тогда
G этилен с уч. потерь = Gэтилена с уч. конверсии, (п 5) + G потерь синтеза = кг/ч
8 Рассчитать количество технического этилена:
Таблица 1 - Количество этилена технического
| Качественный состав | ω i, % масс | Gi , кг/ч |
| С2Н4 С2Н6 | Исходные данные Исходные данные | G этилен с уч. потерь (п 7) |
| Итого | Gпотока(G1) |
Рассчитать количество компонентов:
Gi =(G потока · ω i) /100% (3)
где G потока - количество этилена, кг/ч.
9 Рассчитать расход катализаторного раствора: Vкат р-ра =G ацетальдегида с уч.потерь(п 2) / 6,0= м3/ч
где G ацетальдегида с уч.потерь (п 2) – производительность установки по ацетальдегиду, кг/ч;
6,0 - производительность катализаторного раствора по ацетальдегиду, кг/м3.
Тогда его расход катализаторного раствора:
G кат р-ра =G2= (G ацетальдегида с уч.потерь(п 2) / 6,0) ∙ ρкат. р-ра = кг/ч
10 Рассчитать количество циркулирующего катализаторного раствора:
Таблица 2 - Количество катализаторного раствора
| Качественный состав | ω i, % масс | Gi , кг/ч |
| PdCl2 CuCl2 CН3СООН НСl Н2О | Исходные данные Исходные данные Исходные данные Исходные данные Исходные данные | |
| Итого | Gпотока(G2) |
Рассчитать по формуле 3 количество компонентов.
11 Рассчитать количество исходной смеси: G3 =G1 +G2
Таблица 3 - Количество исходной смеси
| Качественный состав | ω i, % масс | Gi , кг/ч |
| Этилен технический: С2Н4 С2Н6 Катализаторный раствор PdCl2 CuCl2 CН3СООН НСl Н2О | ||
| Итого | Gпотока(G3) |
Рассчитать массовый состав компонентов:
ω i =(Gi ·100) / G потока (4)
12 Рассчитать количество этилена, пошедшего на реакции 1:
Х1 У1 G ацетальдегида с уч.потерь, (п.2) кг/ч
С2Н4 + 0,5О2 → CH3-COH
28кг/кмоль 32 кг/кмоль 44 кг/кмоль
G1(С2Н4)= Х1 =(G ацетальдегида с уч.потерь, (п.2) ∙ 28) /44= кг/ч,
G1(О2)= У1 = (G ацетальдегида с уч.потерь, (п.2) ∙ 0,5 ∙32) /44= кг/ч.
Определить количество этилена, затраченного на вторую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G2 С2Н4 - ωэт на укс к-ту, %
G2 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на укс к-ту/100 = кг/ч
G 2 С2Н4, кг/ч У2 Z2
28кг/кмоль 32 кг/кмоль 60 кг/кмоль
G2 (О2)=У2 =(G 2 С2Н4 ∙32) /28= кг/ч,
G2 (СН3СООН)= Z2 =(G 2 С2Н4 ∙60) /28= кг/ч.
Определить количество этилена, затраченного на третью реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G 3 С2Н4 - ωэт на СО2, %
G3 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на СО2/100 = кг/ч
G3 С2Н4,кг/ч Х3 У3 Z3
С2Н4 + 3О2 2СО2 + 2Н2О
28кг/кмоль 32 кг/кмоль 44 кг/кмоль 18 кг/кмоль
G3(О2)= Х3 = (G3 С2Н4 ∙32∙3) /28 = кг/ч,
G3 (СО2)= У3= (G3 С2Н4 ∙44∙2) /28 = кг/ч,
G3(Н2О)= Z3 =(G3 С2Н4 ∙18∙2) /28 = кг/ч.
Определить количество этилена, затраченного на четвертую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G4 С2Н4 - ωэт на щав. к-ту, %
G4 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на щав.к-ту/100 = кг/ч
G4 С2Н4, кг/ч Х4 У4 Z4
С2Н4 + 2,5О2 Н2С2О4 + Н2О
28кг/кмоль 32 кг/кмоль 90 кг/кмоль 18 кг/кмоль
G4 (О2)= Х4=(G4 С2Н4 ∙32∙2,5) /28 = кг/ч,
G4 (Н2С2О4)= У4=(G4 С2Н4 ∙90) /28 = кг/ч,
G4 (Н2О)= Z4 =(G4 С2Н4 ∙ 18) /28 = кг/ч.
Определить количество этилена, затраченного на пятую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G5 С2Н4 - ωэт на крот. альд, %
G5 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на крот.альд/100 = кг/ч
G5 С2Н4, кг/ч Х5 У5 Z5
2С2Н4 + О2 СН3-СН=СН-СНО + Н2О
28кг/кмоль 32 кг/кмоль 70 кг/кмоль 18 кг/кмоль
G5 (О2)= Х5=(G5 С2Н4 ∙32) /28∙ 2 = кг/ч,
G5 (СН3-СН=СН-СНО)= У5=(G5 С2Н4 ∙70) /28∙ 2 = кг/ч,
G5 (Н2О)= Z5 =(G5 С2Н4 ∙ 18) /28∙ 2 = кг/ч.
Определить количество этилена, затраченного на шестую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G6 С2Н4 - ωэт на ВМС, %
G6 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на ВМС/100 = кг/ч
G6 С2Н4, кг/ч Х6 У6
nС2Н4 + 0,5nО2 [-С2Н4О-]n
28кг/кмоль 32 кг/кмоль 44 кг/кмоль
G6 (О2)= Х6=(G6 С2Н4 ∙32∙ 0,5) /28 = кг/ч,
G6 ([-С2Н4О-]n)= У6=(G6 С2Н4 ∙44) /28 = кг/ч.
Определить количество этилена, затраченного на седьмую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G7 С2Н4 - ωэт на С2Н5Сl, %
G7 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на С2Н5Сl /100 = кг/ч
G7 С2Н4, кг/ч Х7 У7
С2Н4 + НСl С2Н5Сl
28кг/кмоль 36,5 кг/кмоль 64,5 кг/кмоль
G7 (НСl)= Х7=(G7 С2Н4 ∙36,5) /28 = кг/ч,
G7 (С2Н5Сl)= У7=(G7 С2Н4 ∙64,5) /28 = кг/ч.
Определить количество этилена, затраченного на восьмую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G8 С2Н4 - ωэт на СlСН2СНО, %
G8 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на СlСН2СНО /100 = кг/ч
G8 С2Н4, кг/ч Р8 Х8 У8 Z8
С2Н4 + НСl + О2 СlСН2СНО + Н2О
28кг/кмоль 36,5 кг/кмоль 32 кг/кмоль 78,5 кг/кмоль 18 кг/кмоль
G8 (О2)= Х8=(G8 С2Н4 ∙32) /28 = кг/ч,
G8 (СlСН2СНО)= У8=(G8 С2Н4 ∙78,5) /28 = кг/ч,
G8 (НСl)= P8=(G8 С2Н4 ∙36,5) /28 = кг/ч,
G8 (Н2О)= Z8=(G8 С2Н4 ∙18) /28 = кг/ч.
Определить количество этилена, затраченного на девятую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G9 С2Н4 - ωэт на СНСl2-СНО, %
G9 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на СНСl2-СНО /100 = кг/ч
G9 С2Н4, кг/ч Р9 Х9 У9 Z9
С2Н4 + 2НСl + 1,5О2 СНСl2-СНО + 2Н2О
28кг/кмоль 36,5 кг/кмоль 32 кг/кмоль 113 кг/кмоль 18 кг/кмоль
G9 (О2)= Х9=(G9 С2Н4 ∙32 ∙ 1,5) /28 = кг/ч,
G9 (СНСl2-СНО)= У9=(G9 С2Н4 ∙113) /28 = кг/ч,
G9 (НСl)= P9=(G9 С2Н4 ∙36,5 ∙2) /28 = кг/ч,
G9 (Н2О)= Z9=(G9 С2Н4 ∙18∙2) /28 = кг/ч.
Определить количество этилена, затраченного на десятую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G10 С2Н4 - ωэт на ССl3 –СНО, %
G10 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на ССl3 –СНО /100 = кг/ч
G10 С2Н4, кг/ч Р10 Х10 У10 Z10
С2Н4 + 3НСl + 2О2 ССl3 –СНО + 3Н2О 28кг/кмоль 36,5 кг/кмоль 32 кг/кмоль 147,5 кг/кмоль 18 кг/кмоль
G10 (О2)= Х10=(G10 С2Н4 ∙32 ∙2) /28 = кг/ч,
G10 (ССl3 –СНО)= У10=(G10 С2Н4 ∙147,5) /28 = кг/ч,
G10 (НСl)= P10=(G10 С2Н4 ∙36,5 ∙ 3) /28 = кг/ч,
G10 (Н2О)= Z10=(G10 С2Н4 ∙18 ∙ 3) /28 = кг/ч.
Определить количество этилена, затраченного на одиннадцатую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G11 С2Н4 - ωэт на СНСl3, %
G11 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на СНСl3/100 = кг/ч
G11 С2Н4, кг/ч Р11 Х11 У11 Z11
С2Н4 + 6НСl + 2О2 2 СНСl3 + 4Н2О
28кг/кмоль 36,5 кг/кмоль 32 кг/кмоль 119,5 кг/кмоль 18 кг/кмоль
G11 (О2)= Х11=(G11 С2Н4 ∙32 ∙2) /28 = кг/ч,
G11 (СНСl3)= У11=(G11 С2Н4 ∙119,5 ∙ 2) /28 = кг/ч,
G11 (НСl)= P11=(G11 С2Н4 ∙36,5 ∙ 6) /28 = кг/ч,
G11 (Н2О)= Z11=(G11 С2Н4 ∙18 ∙ 4) /28 = кг/ч.
Определить количество этилена, затраченного на двенадцатую реакцию:
Gэтилена с уч. селективности (п.4) – 100%
G12 С2Н4 - ωэт на СН2Сl2, %
G12 С2Н4 = Gэтилена с уч. селективности (п.4) ∙ ωэт на СН2Сl2 /100 = кг/ч
G12 С2Н4, кг/ч Р12 Х12 У12 Z12
С2Н4 + 4НСl + О2 2СН2Сl2 + 2Н2О
28кг/кмоль 36,5 кг/кмоль 32 кг/кмоль 85 кг/кмоль 18 кг/кмоль
G 12 (О2)= Х12=(G12 С2Н4 ∙32) /28 = кг/ч,
G 12(СН2Сl2)= У12=(G12 С2Н4 ∙85 ∙ 2) /28 = кг/ч,
G 12 (НСl)= P12=(G12 С2Н4 ∙36,5∙ 4) /28 = кг/ч,
G 12 (Н2О)= Z12=(G12 С2Н4 ∙18 ∙ 2) /28 = кг/ч.
13 Допускается, что окисление этилена происходит воздухом и хлороводородом, поэтому по уравнениям реакции рассчитать кислород и хлороводород, израсходованные на реакции:
Всего расходуется кислорода на реакции 1-6, 8-12:
G общ(О2)= Х1+ Х2+ Х3+ Х4+ Х5+ Х6+ Х8+ Х9+ Х10+ Х11+ Х12= кг/ч
Всего расходуется хлороводорода: G общ (HCl)= Х7 + P8+ P9+ P10+ P11+ P12= кг/ч
Всего образуется водяного пара: Gобщ (Н2О(пар))= Z3+ Z4+ Z5+ Z8+ Z9+ Z10+ Z11 + Z12= кг/ч
Расход воздуха на окисление рассчитать по уравнению:
0,209Vx – φO2(Vx – VO2) = VO2 (5)
где Vx – расход воздуха, м3/ч;
0,209 – объемная доля кислорода в воздухе, доли ед.;
φO2 – объемная доля кислорода в отработанном воздухе, доли ед.;
VO2 – расход кислорода на окисление этилена, м3/ч.
Расход кислорода израсходованного на процесс окисление этилена:
n=m / M (6)
где: m =G общ(О2)- масса вещества, г;
M - молярная масса, кмоль.
n= кмоль/ч
V=n · 22, 4 (7)
где: n- количество вещества, кмоль;
22,4 –молярный объем идеального газа при нормальных условиях, м³/кмоль.
VO2 = м3/ч
Расход объема воздуха поданного в реактор Р2 по формуле: 0,169 Vx = VO2
Vx = м3/ч.
14 Рассчитать количество воздуха на окисление:
Таблица 4 - Количество воздуха на окисление
| Качественный состав | φi, % об. | Vi,м3/ч | ni кмоль/ч ni = Vi/22,4 | Gi, кг/ч Gi = ni ∙Mi | ω i, %масс |
| О2 N2 | Исходные данные Исходные данные | По формуле 8 По формуле 8 | |||
| Итого | Vx | nx | Gпотока(G 18) |
Рассчитать объём каждого компонента в смеси:
Vi =Vx ∙φi/100 (8)
где: Vx – объём потока, м3/ч;
φi - объёмная доля компонента в потоке, %.
Рассчитать массовый состав компонентов по формуле 4
15 Рассчитать количество воздуха, поданного на активацию и окисление:
G16 = G 18∙ 100 / ωвоздуха на окисл (исх.данные)= кг/ч
Таблица 5 - Количество воздуха на окисление и активацию
| Качественный состав | ω i, % масс | Gi , кг/ч |
| О2 N2 | Табл.4 Табл.4 | |
| Итого | Gпотока(G16) |
Рассчитать по формуле 3 количество компонентов.
16 Рассчитать расход воздуха, поступившего на активацию катализаторного раствора: G17 =G 16 -G18
Таблица 6 - Количество воздуха, поступившего на активацию
| Качественный состав | ω i, % масс | Gi , кг/ч |
| О2 N2 | ||
| Итого | Gпотока(G17) |
Рассчитать массовый состав компонентов по формуле 4
17 Рассчитать состав отработанного воздуха: G21 О2= G18 О2 -G общ(О2) (п.13)
Таблица 7 – Количество отработанного воздуха
| Качественный состав | ω i, % масс | Gi , кг/ч |
| О2 N2 | G21 О2= G18 О2 -G общ(О2) (п.13) G21 N2 (табл. 5) | |
| Итого | Gпотока(G21) |
Рассчитать массовый состав компонентов по формуле 4
Допускается, что количество катализаторного раствора на выходе из реактора уменьшается за счет прореагировавшего кислорода и хлороводорода:
G кат-ного р-ра на выходе из Р1 = G2 (табл. 2)- (G общ (HCl) (п.13)+ G общ(О2) (п.13))= кг/ч
18 Рассчитать количество реакционной смеси после реактора Р1:
Таблица 8 – Количество реакционной массы окисления
| Качественный состав | ω i, % масс | Gi , кг/ч |
| СН3СНО СН3СООН Н2С2О4 СН3-СН=СН-СНО СlСН2СНО СНСl2-СНО ССl3 –СНО С2Н5Сl СН2Сl2 СНСl3 Н2О С2Н4 Полимеры С2Н6 СО2 Катализаторный раствор: PdCl2 CuCl2 CН3СООН НСl Н2О | G ацетальдегида с уч.потерь (п.2) G2 (СН3СООН)= Z2 (п.12) G4 (Н2С2О4)= У4(п.12) G5(СН3-СН=СН-СНО)= У5(п.12) G8 (СlСН2СНО)= У8(п.12) G9 (СНСl2-СНО)= У9(п.12) G10 (ССl3 –СНО)= У10(п.12) G7 (С2Н5Сl)= У7(п.12) G 12(СН2Сl2)= У12(п.12) Табл.3 G общ(Н2О(пар)) (п.13) G этилена невступившего в р –цию (п.6) + G потерь синтеза (поток G5) (п.7) G6 ([-С2Н4О-]n)= У6(п.12) Табл.1 G3 (СО2)= У3(п.12) Табл.3 Табл.3 Табл.3 G НСl (Табл.3)- G общ (HCl) (п.13) G Н2О (Табл.2)- G общ(О2) (п.13) | |
| Итого | Gпотока(G4) |
Рассчитать массовый состав компонентов по формуле 4.
1 19 Рассчитать количество реакционной массы без потерь: G6 =G4 -G5 (п.7)
3 Таблица 9 – Количество реакционной массы без потерь
| Качественный состав | ω i, % масс | Gi , кг/ч |
| СН3СНО СН3СООН Н2С2О4 СН3-СН=СН-СНО СlСН2СНО СНСl2-СНО ССl3 –СНО С2Н5Сl СН2Сl2 СНСl3 Н2О С2Н4 Полимеры С2Н6 СО2 Катализаторный раствор: PdCl2 CuCl2 CН3СООН НСl Н2О | ||
| Итого | Gпотока(G6) |
Рассчитать массовый состав компонентов по формуле 4
20 Рассчитать количество фузельной воды или кубовой жидкости со стадии ректификации, который требуется для подержания постоянной концентрации катализаторного раствора в колонне:
Gфузельная вода (G7)= G ацетальдегида с уч.потерь (п.2) ·2= кг/ч
21 Рассчитать количество фузельной воды:
Таблица 10 – Количество фузельной воды
| Качественный состав | ω i, % масс | Gi , кг/ч |
| Н2О СН3СНО СН3СООН | Исходные данные Исходные данные Исходные данные | |
| Итого | Gпотока(G7) |
Рассчитать по формуле 3 количество компонентов.
22 Рассчитать количество фузельной воды и реакционной массы в колонне К1: G8 =G6 +G7
Таблица 11 – Количество фузельной воды и реакционной массы
| Качественный состав | ω i, % масс | Gi , кг/ч |
| СН3СНО СН3СООН Н2С2О4 СН3-СН=СН-СНО СlСН2СНО СНСl2-СНО ССl3 –СНО С2Н5Сl СН2Сl2 СНСl3 Н2О С2Н4 Полимеры С2Н6 СО2 Катализаторный раствор: PdCl2 CuCl2 CН3СООН НСl Н2О Фузельная вода Н2О СН3СНО СН3СООН | ||
| Итого | Gпотока(G8) |
Рассчитать массовый состав компонентов по формуле 4
23 Рассчитать количество паров ацетальдегида и воды (G9). Известно, что в газовую фазу входят все компоненты, кроме щавелевой кислоты и катализаторного раствора:
Таблица 12 – Количество паров ацетальдегида и воды
| Качественный состав | ω i, % масс | Gi , кг/ч |
| СН3СНО СН3СООН СН3-СН=СН-СНО СlСН2СНО СНСl2-СНО ССl3 –СНО С2Н5Сl СН2Сl2 СНСl3 Н2О С2Н4 Полимеры С2Н6 СО2 Фузельная вода Н2О СН3СНО СН3СОOH | Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 Табл.11 | |
| Итого | Gпотока(G9) |
Рассчитать массовый состав компонентов по формуле 4
24 Рассчитать количество катализаторного раствора из колонны К1: G10 =G8 -G9
Таблица 13 – Количество катализаторного раствора
| Качественный состав | ω i, % масс | Gi , кг/ч |
| PdCl2 CuCl2 CН3СООН НСl Н2О Н2С2О4 | ||
| Итого: | Gпотока(G10) |
Рассчитать массовый состав компонентов по формуле 4
25 Рассчитать количество реакционной массы, пошедшей на ректификацию:
Таблица 14 – Количество реакционной массы
| Качественный состав | ω i, % масс | Gi , кг/ч |
| СН3СНО СН3СООН СН3-СН=СН-СНО СlСН2СНО СНСl2-СНО ССl3 –СНО С2Н5Сl СН2Сl2 СНСl3 Н2О С2Н4 Полимеры С2Н6 СО2 | Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 Табл.12 | |
| Итого | Gпотока(G11) |
Рассчитать массовый состав компонентов по формуле 4
26 Рассчитать количество воды после сепаратора: G12 =G9 -G11
Таблица 15 – Количество воды
| Качественный состав | ω i, % масс | Gi , кг/ч |
| Н2О СН3СНО СН3СООН | ||
| Итого | Gпотока(G12) |
Рассчитать массовый состав компонентов по формуле 4
27 Рассчитать расход парового конденсата (поток G13):
G парового конденсата (G13) =0,2∙ G ацетальдегида с уч.потерь (п.2) = кг/ч
28 Рассчитать количество реакционной смеси: G14 =G10 +G12 +G13
Таблица 16 – Количество реакционной смеси
| Качественный состав | ω i, % масс | Gi , кг/ч |
| Фузельная вода Н2О СН3СНО СН3СООН Катализаторный р-р PdCl2 CuCl2 CН3СООН НСl Н2О Н2С2О4 Паровой конденсат | ||
| Итого | Gпотока(G14) |
Рассчитать массовый состав компонентов по формуле 4
29 Рассчитать расход активированного катализаторного раствора:
G15 активирю кат-ного р-ра= G ацетальдегида с уч.потерь (п.2) ∙ Ракт кат-ра(исх. данные) = кг/ч
30 Рассчитать количество исходной смеси: G19 =G14 +G15 +G18
Таблица 17 – Количество исходной смеси
| Качественный состав | ω i, % масс | Gi , кг/ч |
| Фузельная вода: Н2О СН3СНО СН3СООН Катализаторный раствор: PdCl2 CuCl2 CН3СООН НСl Н2О Н2С2О4 Паровой конденсат Кислород О2 Азот N2 Активированный катализаторный раствор | ||
| Итого | Gпотока(G19) |
Рассчитать массовый состав компонентов по формуле 4
31 Рассчитать количество катализаторного раствора, подаваемого на активацию:
Gкат-ного р-ра на активацию = (G18 (табл. 4)+ G10(табл.13)+ G13 (п.27)+ G15 активирю кат-ного р-ра (п.29)+ G7 (табл.10)) –
(G2 (табл.2)+ G21 (табл.7)) = кг/ч
32 Рассчитать количество катализаторного раствора, выходящий из реактора Р2:
Таблица 18 - Количество катализаторного раствора на выходе из реактора Р2
| Качественный состав | ω i, % масс | Gi , кг/ч |
| PdCl2 CuCl2 CН3СООН НСl Н2О Активированный катализаторный раствор | Табл.17 Табл.17 Табл.17 Табл.2 Табл.2 Gкат-ного р-ра на активацию (п.31) | |
| Итого | Gпотока(G22) |
Рассчитать массовый состав компонентов по формуле 4
33 Рассчитать количество реакционной массы:
Таблица 19 - Количество катализаторного раствора после сепаратора
| Качественный состав | ω i, % масс | Gi , кг/ч |
| PdCl2 CuCl2 CН3СООН НСl Н2О Активированный кат. р-р Отработанный воздух Кислород О2 Азот N2 | Табл.18 Табл.18 Табл.18 Табл.18 Табл.18 Табл.18 Табл.7 Табл.7 | |
| Итого | Gпотока(G20) |
Рассчитать массовый состав компонентов по формуле 4.
34 Составить сводную таблицу материального баланса синтеза ацетальдегида:
Таблица 20 – Материальный баланс синтеза ацетальдегида
| Приход | кг/ч | Расход | кг/ч |
| Технический этилен G1 | Циркулирующий катализаторный раствор G2 | ||
| Циркулирующий катализаторный раствор G2 | Потери этилена G5 | ||
| Фузельная вода G7 | Ацетальдегид и хлорорганика G11 | ||
| Паровой конденсат G13 | Воздух на активацию G17 | ||
| Активированный катализаторный раствор G15 | Отработанный воздух G21 | ||
| Воздух на окисление и активацию G16 | Катализаторный раствор на активацию G23 | ||
| Итого | Итого |
 2015-04-20
2015-04-20 1394
1394








