Окисление — наиболее распространенный метод получения различных кислородсодержащих соединений из углеводородного сырья и некоторых функциональных производных углеводородов различных классов. Практическое значение процессов окисления в промышленности основного органического и нефтехимического синтеза трудно переоценить. Их первостепенную роль обусловили следующие причины:
1. Многообразие реакций окисления, что позволяет использовать их для первичной переработки углеводородного сырья и производить на их основе различные ценные соединения (спирты, моно- и дикарбоновые кислоты и их ангидриды, а-оксиды, нитрилы и др.), являющиеся растворителями, промежуточными продуктами органического синтеза, мономерами и исходными веществами в производстве полимерных материалов, поверхностно-активных веществ, пластификаторов и т. д.
2.Доступностью и низкой стоимостью большинства окислителей, среди которых главное место занимает кислород воздуха. Это определяет более высокую экономичность синтеза ряда продуктов методами окисления по сравнению с другими способами их производства. В ряде процессов в качестве агентов окисления можно использовать гипохлориты, хлораты, перманганаты, азотную кислоту и оксид азота(IУ), сульфат ртути, оксиды и пероксиды некоторых металлов, пероксид водорода.
В некоторых случаях одно и то же сырье можно окислять различными агентами, но чаще агенты окисления обладают избирательным действием. На примере этилена можно показать, окислении различными какие продукты образуются при его агентами:
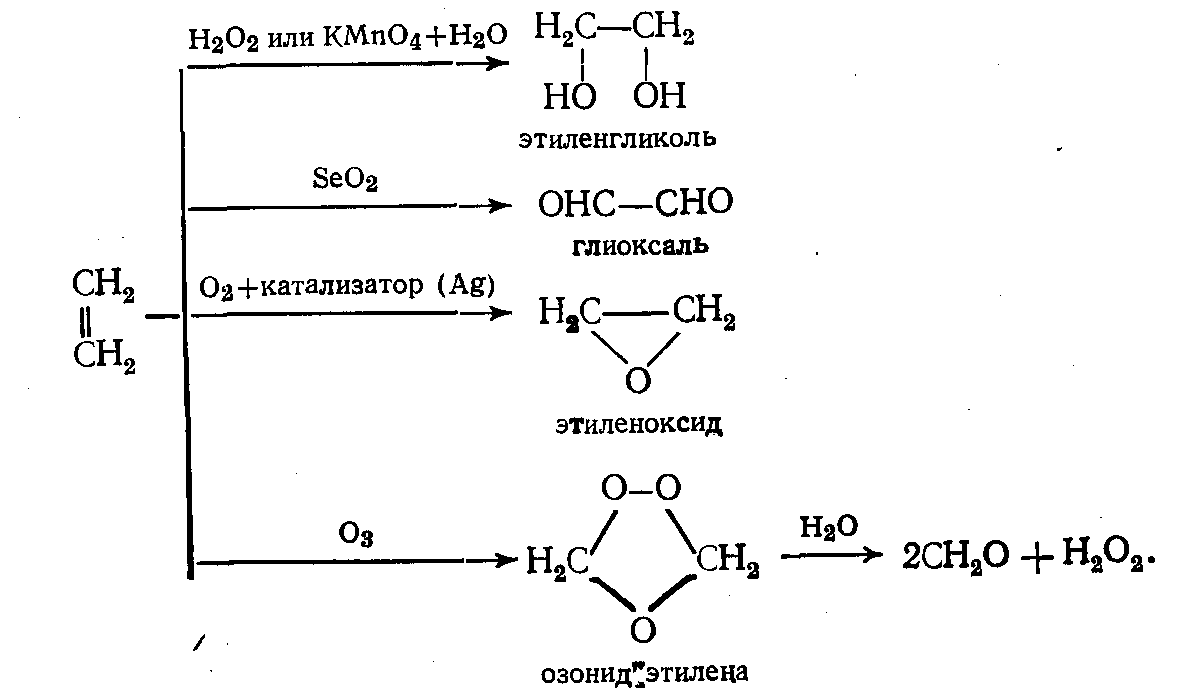
С этой точки зрения окисление следует считать одним из самых перспективных процессов органического синтеза, играющим все более важную роль в научных исследованиях и промышленности.
Дать точное определение реакций окисления в органической химии не так просто. Они большей частью не сопровождаются изменением валентности каких-либо атомов, как в неорганической химии. Это наблюдается только при окислении по атомам азота, серы, фосфора и других элементов, способных существовать в нескольких валентных состояниях: 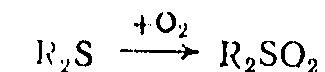
Нельзя выбрать критерием и другой признак и определить окисление, как реакцию введения атомов кислорода в органическую молекулу. Это легко опровергается такими примерами, как гидратация олефинов или гидролиз хлорпроизводных, где кислородосодержащие соединения образуются без окислителей. Дополнительная трудность возникает из-за того, что окисление иногда протекает без увеличения числа атомов кислорода в исходной молекуле или даже с образованием соединений, совсем не содержащих кислорода. В этих случаях окисление сводится к удалению атомов водорода путем их связывания кислородом в виде воды, причем такой же результат обычно достигается и вследствие дегидрирования.
Таким образом, остается считать собственно окислением превращение органических веществ под влиянием тех или иных окисляющих агентов.
В окислительных превращениях следует различать полное и неполное окисление. Под полным окислением понимают процесс сгорания органических веществ с образованием воды, диоксида углерода, оксидов азота и серы: 
Основное назначение этого процесса — получение тепловой энергии для промышленности, транспорта и в быту. Но в промышленности органического синтеза этот процесс является нежелательным, так как ведет к снижению выхода целевого продукта и большому количеству выделяемого тепла.
Имеющие промышленное значение реакции неполного (частичного) окисления можно разделить на три основные группы.
1. Окисление без разрыва связи С—С. В этом случае окисление может протекать: по насыщенному атому углерода парафинов, циклопарафинов, олефинов; по боковым цепям алкилароматических соединений; по частично окисленным атомам углерода в спиртах и альдегидах;
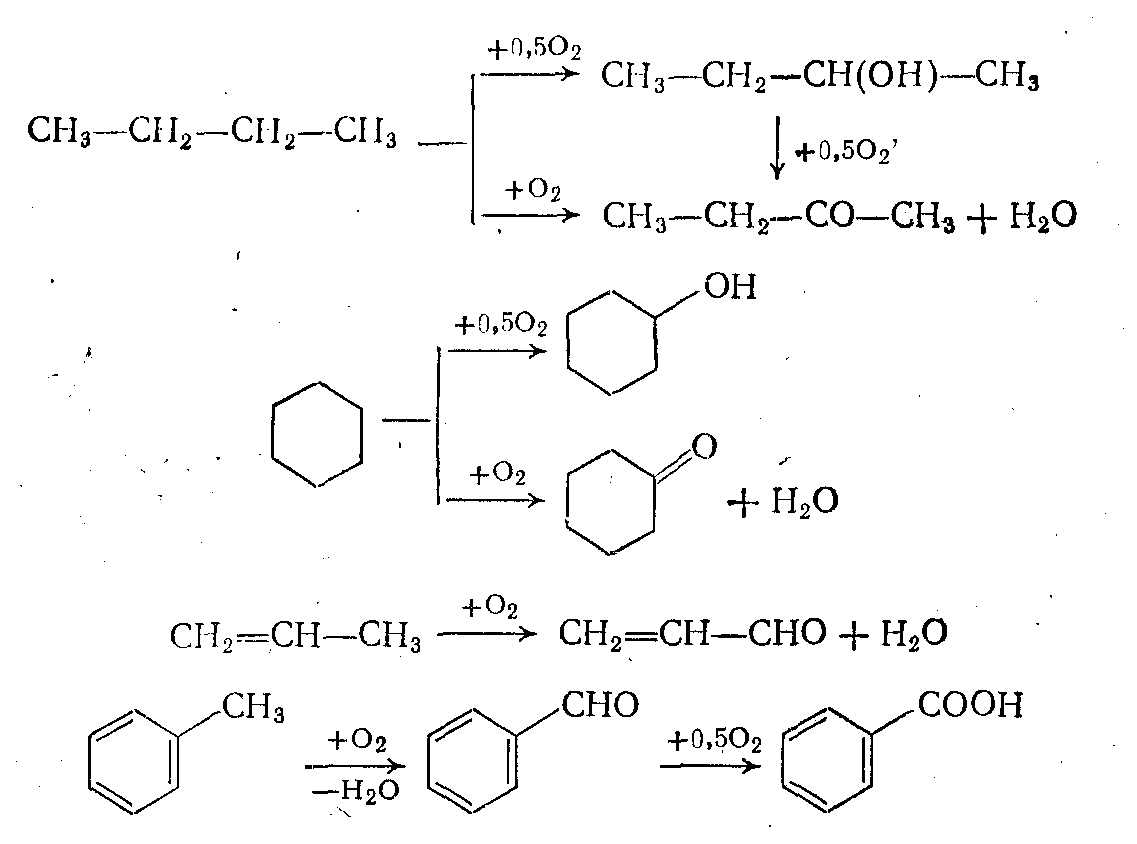
по двойной связи олефинов с образованием карбонильных соединений или а-оксидов (эпоксидирование); по атомам серы, фосфора и других элементов.

2. Деструктивное окисление. В этом случае окисление может протекать по связям: С-С, С=С, С≡С, Саром-Саром.
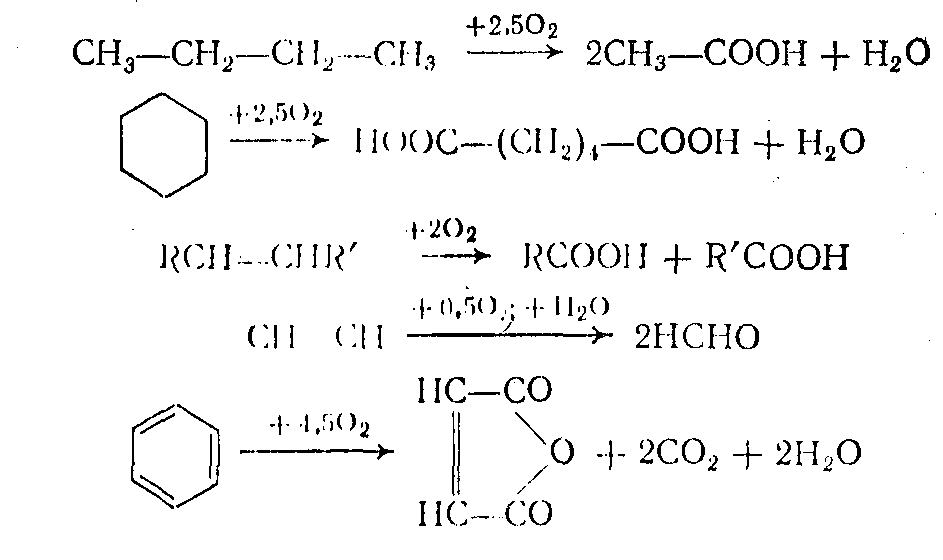
3. Окислительная конденсация, окислительный аммонолиз — окисление, сопровождающееся связыванием молекул исходных реагентов.
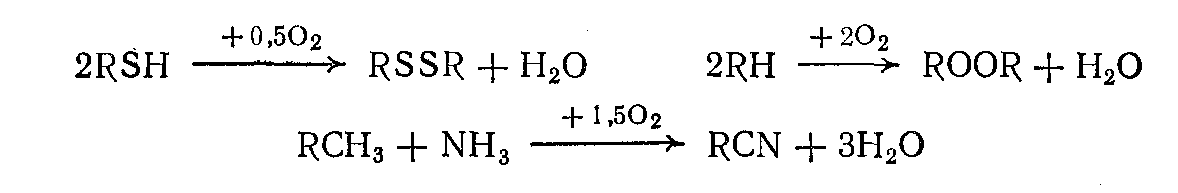
Кроме перечисленных промышленное значение имеют также процессы окислительного дегидрирования, занимающие промежуточное положение между окислением и дегидрированием.
В лабораторной технике и тонком органическом синтезе нередко применяют такие окислительные агенты, как перманганаты (в щелочной, нейтральной или кислой среде), бихроматы, хромовый ангидрид, перекиси некоторых металлов (марганца, свинца, натрия) и т. д., то в промышленности основного органического и нефтехимического синтеза стараются пользоваться более дешевыми окислителями и только в отдельных случаях применяют агенты, способные к реакциям, невыполнимым при помощи других окислителей:
1.Молекулярный кислород (в виде воздуха, технического кислорода или даже азото-кислородных смесей с небольшим содержанием О2) является важнейшим из окислительных агентов. Его применяю для проведения большинства рассмотренных выше реакций окисления. Концентрированный кислород оказывает более сильное окисляющее действие, но его применение связано с дополнительными затратами на разделение воздуха. При окислении в газовой фазе, когда примесь азота затрудняет выделение продуктов или их рециркуляцию, используют и технический кислород. Меньшую скорость реакции при окислении воздухом компенсируют повышением температуры или увеличением общего давления, ведущим к росту парциального давления кислорода.
2.Азотная кислота (реже окислы азота) является вторым по масштабам применения окислительным агентом. Ее действие нередко сопровождается побочным нитрованием органического соединения, усиливающимся с повышением концентрации кислоты. Поэтому для окисления используют 40—60% -ную НNO3.
Азотная кислота как окислитель никогда не применяется для реакций с парафинами. Для нее наиболее типичны реакции деструктивного окисления циклических соединений и веществ с ненасыщенными связями, идущие с участием НNO3 с лучшим выходом, чем при окислении кислородом:
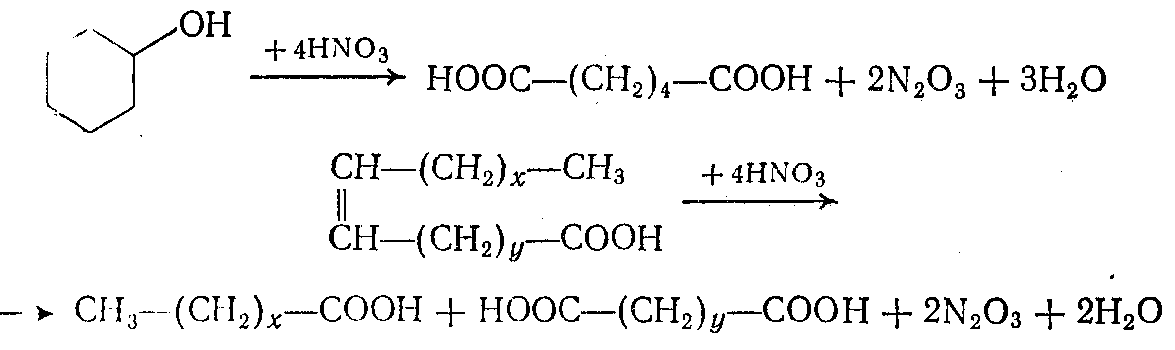
При окислении азотной кислотой последняя раскисляется до окислов азота ( ). Экономичность всего производства многом зависят от возможности утилизации этих окислов в регенерация непревращенной азотной кислоты. Первая задача решается окислением окислов азота воздухом в водном или азотнокислом растворе с образованием азотной кислоты:
). Экономичность всего производства многом зависят от возможности утилизации этих окислов в регенерация непревращенной азотной кислоты. Первая задача решается окислением окислов азота воздухом в водном или азотнокислом растворе с образованием азотной кислоты:
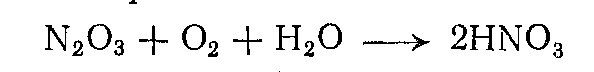
3.Перекисные соединения, главным образом перекись водорода
надуксусная кислота (а в последнее время и гидроперекиси). Ввиду относительной дороговизны их используют только для таких реакций, которые под влиянием молекулярного кислорода или азотной кислоты не протекают. Это прежде всего относится к процессам эпоксидирования ненасыщенных соединений:
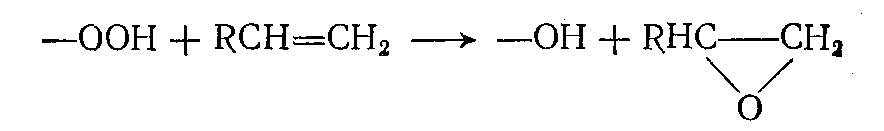
Меньшее значение имеет реакция надкислот с кетонами, ведущая к сложным эфирам или лактонам (реакция Байера — Виллигера):
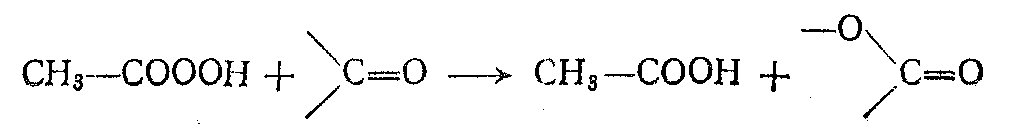
Перекись водорода обычно применяется в виде 30%-ного водного раствора. Она дает с карбоновыми кислотами соответствующие надкислоты по реакции, аналогичной этерификации: 
Окисление практически необратимо, так как его конечные продукты - двуокись углерода и вода — не могут служить восстановителями. Окисление относится к числу самых экзотермических процессов органического синтеза.
Важной характеристикой окисления является период индукции: он может длиться от нескольких секунд до нескольких часов. Продолжительность его уменьшают повышением температуры или добавлением промоторов (пероксидов, альдегидов и др.).
Способность к окислению атомов углерода зависит от энергии разрыва связи С—Н и возрастает в ряду 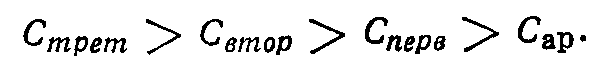 Во избежание превращения сырья в продукты полного окисления и достижения большой степени конверсии и селективности процесс ведут при массовом соотношении кислород: сырье, равном (1: 10)—(1:20), и применяют рециркуляцию.
Во избежание превращения сырья в продукты полного окисления и достижения большой степени конверсии и селективности процесс ведут при массовом соотношении кислород: сырье, равном (1: 10)—(1:20), и применяют рециркуляцию.
Первичным молекулярным продуктом при окислении углеводорода является вторичный гидропероксид. Окисление протекает по цепному свободно-радикальному механизму с вырожденным разветвлением. В несколько упрощенном виде это можно представить следующим образом:
где 1а, 16— зарождение цепи; 2, 3— продолжение цепи; 4— 8 — вырожденное разветвление; 9а—9в — обрыв цепи; М. п. — молекулярные продукты.
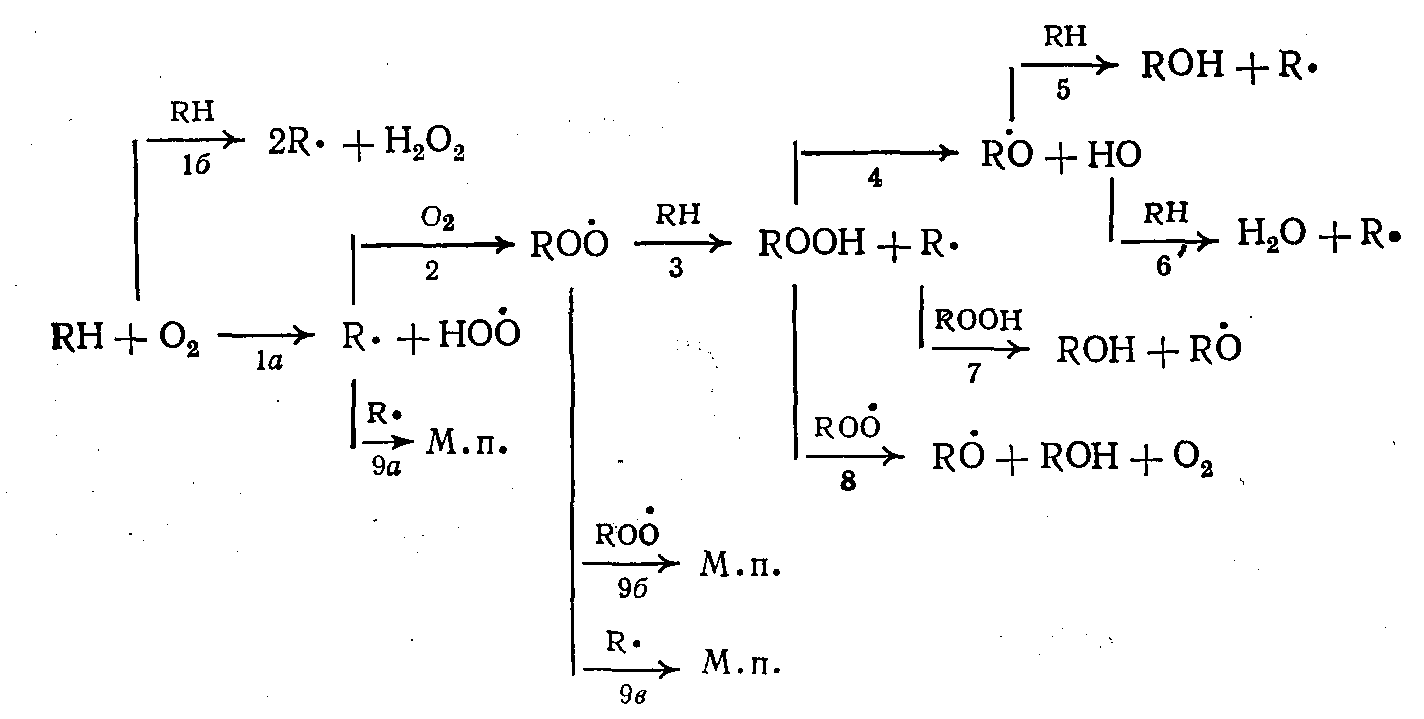
При жидкофазном окислении из-за высокой концентрации углеводородов образование свободных радикалов более вероятно по тримолекулярной реакции 16, чем по бимолекулярной 1а.
Образующийся в процессе гидропероксид далее превращается в молекулярные продукты — спирты, кетоны, сложные эфиры и т. д. Продукты окисления в большинстве своем более реакционноспособны, чем исходный углеводород, и подвергаются дальнейшему окислению со сравнительно большей скоростью.
Радикально-цепное окисление предполагает осуществление цепных реакций с участием углеводородных (R  ) и/или пероксидных (ROO
) и/или пероксидных (ROO  ) радикалов. Последние более устойчивы и чаще вторая из приведенных ниже реакций продолжения (развития) цепи является лимитирующей:
) радикалов. Последние более устойчивы и чаще вторая из приведенных ниже реакций продолжения (развития) цепи является лимитирующей:
R  + O2 ROO
+ O2 ROO  ;2) ROO
;2) ROO  + RH ROOH + R
+ RH ROOH + R  . (1)
. (1)
Гидропероксиды, даже наиболее устойчивые из них, не образуются со 100 %-ой селективностью и содержат примеси соответствующих спиртов, альдегидов и кетонов.
На первой стадии окисления, называемой стадией зарождения цепи, происходит образование свободных радикалов под влиянием внешних факторов (температуры, катализатора, излучения и т.д.):
RH + O2 R  + HOO
+ HOO  (2)
(2)
или (в жидкой фазе):
2RH + O2 2R  + H2O2. (3)
+ H2O2. (3)
пероксид водорода
Установлено, что при жидкофазном окислении углеводородов, у которых прочность связи С – Н более 375 кДж/моль, зарождение цепи происходит по бимолекулярной реакции (1), а для углеводородов с менее прочными связями – по тримолекулярной реакции (2).
Образовавшиеся свободные радикалы вступают в реакцию со стабильными молекулами; при этом происходит развитие (продолжение) цепи.
Продолжение цепи может быть представлено как последовательность двух элементарных актов, в которой во втором акте образуется радикал, начавший цепь и молекула продукта окисления:
R  + O2 ROO
+ O2 ROO  ;(4)
;(4)
ROO  + RH ROOH + R
+ RH ROOH + R  . (5)
. (5)
Так как при газофазном окислении температура (350–500 оС) выше, чем при жидкофазном окислении (100–200 оС), то в условиях первого конкурируют два направления продолжения цепи: а) образование пероксидного радикала и б) образование олефина с тем же числом атомов углерода.
ROO  ; (6)
; (6)
R  + О2
+ О2
олефин +HOO  . (7)
. (7)
Далее превращение пероксидного радикала ROO  идет по двум параллельным направлениям: образования гидропероксида и альдегида. До температуры 200 оС пероксидный радикал реагирует преимущественно с образованием гидропероксида, т.е. по типу неразветвленной цепной реакции:
идет по двум параллельным направлениям: образования гидропероксида и альдегида. До температуры 200 оС пероксидный радикал реагирует преимущественно с образованием гидропероксида, т.е. по типу неразветвленной цепной реакции:
ROO  + RH RООH + R
+ RH RООH + R  . При температурах выше 400 оС существенно сокращается образование гидропероксидов и, преимущественно, образуются альдегиды или кетоны и алкоксирадикал (за счет распада пероксидного радикала):
. При температурах выше 400 оС существенно сокращается образование гидропероксидов и, преимущественно, образуются альдегиды или кетоны и алкоксирадикал (за счет распада пероксидного радикала):
R/СНО + R//О  ; (9) изомеризация распад альдегид
; (9) изомеризация распад альдегид
ROO  R/СНR//
R/СНR//
R/СОR// + НО  . (10) ОО
. (10) ОО  кетон
кетон
При газофазном окислении преобладают реакции распада, где значительную роль играет радикал НОО  , который генерирует новые радикалы, образуя пероксид водорода Н2О2, распадающийся на два радикала НО
, который генерирует новые радикалы, образуя пероксид водорода Н2О2, распадающийся на два радикала НО  .
.
Продолжение цепи происходит также в результате взаимодействия пероксидного радикала с молекулами альдегидов, кетонов, спиртов, образовавшихся в предыдущих стадиях:
ROOН
ROO  + R/СНО R///
+ R/СНО R///  + молекулярные продукты. (11)
+ молекулярные продукты. (11)
R/СОR//
Распад гидропероксида и взаимодействие его с другими продуктами обусловливает вырожденное разветвление цепи: RООН RO  + НО
+ НО  ; (12)
; (12)
RООН + R/СОR// RO  + R/ R//СО
+ R/ R//СО  . (13)
. (13)
ﺍ
ОН
В условиях жидкофазного окисления распад гидропероксида также идет и по реакциям второго порядка: через стадию ассоциации гидропероксида в димер, который распадается с большей скоростью, чем гидропероксид: 2RООН RОО…НООR RО  + Н2О + RОО
+ Н2О + RОО  . (14)
. (14)
Н
Поэтому вещества, способные к образованию водородных связей, (спирты, кислоты и др.), ускоряют вырожденное разветвление цепи:
RОО…НОR/ RО  + Н2О + R/О
+ Н2О + R/О  ; (15)
; (15)
Н
RОО…НОСR RО  + Н2О + RСО
+ Н2О + RСО  . (16)
. (16)
Н О
При взаимодействии двух свободных радикалов происходит обрыв цепи с образованием молекулярных продуктов: 2R  R – R; (17)
R – R; (17)
Алкан
2R  R/СН = СН2 + R//Н; (18)
R/СН = СН2 + R//Н; (18)
алкен алкан
2R  + 2RОО
+ 2RОО  2RООR + О2. (1 9)
2RООR + О2. (1 9)
пероксид
Так как в реакционной смеси преобладают наименее реакционноспособные пероксидные радикалы, то обрыв цепи чаще происходит на них.
Обрыв цепи вызывают также ингибиторы, которыми могут служить фенолы, амины, меркаптаны и т.д. При взаимодействии с пероксидными и другими радикалами ингибиторы образуют стабильные продукты:
RОО  + InH Стабильные продукты
+ InH Стабильные продукты
В условиях газофазного окисления обрыв цепи большей частью происходит в результате захвата радикала поверхностью стенок аппарата:
RОО 
НОО  Захват радикала поверхностью стенки
Захват радикала поверхностью стенки
НО 
Состав конечных продуктов в основном определяется условиями проведения процесса, природой исходного углеводородного сырья и образовавшихся пероксидов.
Первичные и вторичные гидропероксиды под влиянием свободных радикалов образуют неустойчивые радикал-гидропероксиды, распад которых приводит к образованию альдегидов и кетонов:
НО 

RСН2ООН RСНООН RСНО + НО  ; (20)
; (20)
– Н2О альдегид
НО 

R2СНООН R2СООН R2СО + НО  . (21)
. (21)
– Н2О кетон
Третичные пероксиды при цепной реакции дают не только спирт с тем же числом углеродных атомов, но и кетон и спирт, являющиеся продукта-ми деструкции по связи С – С.
R/  R2СО + R
R2СО + R  ; (22)
; (22)
R3СООН R3СО  +R/ H кетон
+R/ H кетон
– R/ОН R3СОН + R/  . (23)
. (23)
спирт
Образовавшиеся продукты окисления (спирты, альдегиды, кетоны) при дальнейшем действии О 2 могут претерпевать более глубокие превращения. В условиях газофазного окисления образующиеся продукты больше подвергаются окислительному действию, чем в жидкофазном. Поэтому в газофазных процессах продукты окисления содержат практически все возможные кислородсодержащие продукты, включая оксиды углерода.
На практике для сокращения периода индукции, увеличения скорости и селективности процесса применяют гомогеннокаталитические добавки. В газофазном окислении такими добавками являются оксиды азота, хлор, бромид водорода; в жидкофазном – растворимые в воде соли металлов переменной валентности (кобальта, меди, марганца, железа и др.).Экспериментальные данные позволяют принять такую последовательность окислительных превращений углеводорода:
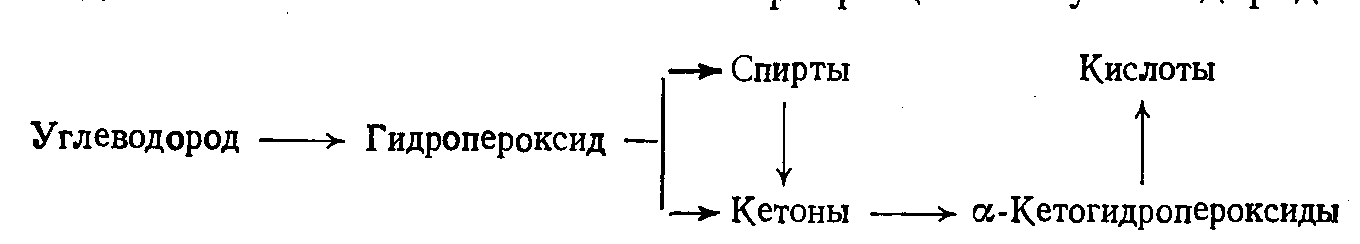
На начальном этапе окисления углеводорода скорость образования промежуточных кислородсодержащих соединений больше скорости их последующего превращения, в результате чего концентрация этих соединений возрастает во времени.
С другой стороны, по мере роста их концентрации скорость превращения кислородсодержащих соединений увеличивается. Это приводит к состоянию, при котором скорости образования и превращения промежуточных соединений становятся практически равными, а суммарная концентрация их — максимальной для данных условий. Максимально возможная концентрация этих соединений зависит от их реакционной способности: чем меньше реакционная способность промежуточного соединения, тем выше его кинетически равновесная концентрация и, следовательно, тем больше его доля в продуктах окисления.
Окисление спиртов по гидроксильной группе протекает в 15—20 раз быстрее, чем по метиленовым группам, и в случае вторичных спиртов приводит к образованию главным образом кетонов. При дальнейшем окислении кетонов получаются продукты более глубокого окисления — кислоты, сложные эфиры, оксикислоты, лактоны и др. При образовании кислот происходит разрыв углеродной цепочки исходной молекулы. Поэтому карбоксилсодержащие продукты окисления могут значительно отличаться от исходного углеводорода по молекулярной массе.
 2015-04-20
2015-04-20 4416
4416
