Удельная теплоемкость – теплота, которую надо сообщить 1 кг вещества для повышения его температуры на 1 К:
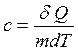 , (11.10)
, (11.10)
где т – масса вещества.
Пользуются также понятием молярной теплоемкости (для одного моля вещества):
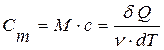 , (11.11)
, (11.11)
где М – молярная масса вещества, v – количество молей вещества.
Если известны удельная и молярная теплоемкость вещества, то теплоемкость конкретного тела можно определить как 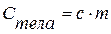 или
или 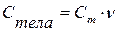 .
.
Различают теплоемкости при постоянном давлении и при постоянном объеме. Для ИГ, рассматривая уравнение (11.4) совместно с уравнением (11.3) и (11.5), получают, что при постоянном объеме молярная теплоемкость равна
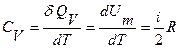 , (11.12)
, (11.12)
а при постоянном давлении -
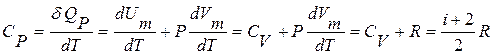 . (11.13)
. (11.13)
Уравнение (11.13) - уравнение Ю.Р.Майера (1814–1878): выводится с учетом уравнения Менделеева–Клапейрона РVm=RT и РdVm+VmdР= РdVm=RdT при постоянном давлении.
При сравнении уравнений (11.12) и (11.13) видно, что молярная теплоемкость при постоянном давлении больше, т.к. часть подводимой теплоты расходуется еще и на совершение ИГ работы расширения (против внешних сил).
На практике часто используют отношение теплоемкостей 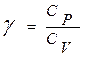 (показатель адиабаты или показатель Пуассона). Так как
(показатель адиабаты или показатель Пуассона). Так как 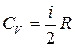 и
и 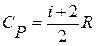 , то для одноатомного газа i =3 и показатель адиабаты
, то для одноатомного газа i =3 и показатель адиабаты 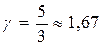 ; для двухатомного i =5 и показатель Пуассона
; для двухатомного i =5 и показатель Пуассона 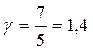 ; для трех- и более – i =6 и
; для трех- и более – i =6 и 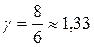 .
.
Приведенные выше рассуждения классической (не квантовой) теории теплоемкости справедливы лишь для ИГ, т.е. в ряде частных случаев, и потому ограниченно применимы.
 2015-05-05
2015-05-05 611
611








