1. Действие группового реактива.
Групповым реактивом является гидроксид натрия.
С катионом алюминия дает белый аморфный осадок гидроксида алюминия.
3+ -
AI + 3OH = AI(OH)3
Полное осаждение гидроксида алюминия достигается при рН=5-9.
С катионом хрома дает осадок гидроксида хрома(III) серо-зеленого или серо-фиолетового цвета.
3+ -
Cr + 3OH = Cr(OH)3
С катионом цинка дает белый осадок гидроксида цинка.
2+ -
Zn + 2OH = Zn(OH)2
Гидроксид цинка растворяется в растворе аммиака.
2+ -
Zn(OH)2 + 6NH4OH = [Zn(NH3)6] + 2OH + 6H2O
С катионом олова (II) дает белый аморфный осадок гидроксида олова (II).
2+ -
Sn + 2OH = Sn(OH)2
Осадок амфотерен. Легко растворяется в гидроксиде натрия.
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
С катионом олова (IV) дает белый студенистый осадок ортооловянной кислоты.
2- - -
[SnCI6] + 4OH = H4SnO4 + 6CI
Осадок растворим в избытке гидроксида натрия и в соляной кислоте.
H4SnO4 + 2NaOH = Na2[Sn(OH)6]; H4SnO4 + 6HCI = H2[SnCI6] + 4H2O
2. Реакции катиона алюминия.
1) Соли слабых кислот и сильных оснований (Na2CO3, Na2SO3, KNO2).
Дают с солями алюминия осадок гидроксида алюминия.
3+ 2-
2AI + 3CO3 + 3H2O = 2AI(OH)3 + 3CO2
2) Гидрофосфат натрия.
Дает белый осадок фосфата алюминия.
3+ 2- +
AI + HPO4 = AIPO4 + H
Осадок растворим в сильных кислотах и не растворим в уксусной кислоте.
3) Ализарин (1,2-диоксиантрохинон).
Дает с гидроксидом алюминия малорастворимое соединение ярко-красного цвета, называемое «алюминиевый лак».

 HO---------AI--------OH
HO---------AI--------OH
O OH O O
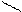








 OH OH
OH OH
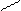 | 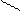 |  |  | ||||||||
 |  | ||||||||||
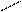
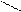 + AI(OH)3 = + H2O
+ AI(OH)3 = + H2O
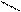 | 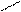 |
O O
К 2-3 каплям раствора соли алюминия прибавьте раствор аммиака до слабощелочной среды, 1-2 капли свежеприготовленного раствора ализарина и нагрейте. При появлении фиолетовой окраски добавьте 1-3 капли раствора уксусной кислоты до ее исчезновения и образования красного лака.
4)Реакция сухим путем (образование тенаровой сини).
Твердые соединения алюминия после обработки их очень разбавленным раствором нитрата кобальта и прокаливания окрашиваются в синий цвет вследствие образования алюмината кобальта, называемого «тенаровой синью».
2AI2(SO4)3 + 2Co(NO3)2 = 2Co(AIO2)2 + 6SO3 + 4NO2 + O2
Для выполнения реакции поместите немного сухой соли алюминия в петлю медной проволоки, смочите 1-2 каплями раствора соли кобальта и прокалите в пламени спиртовки.
3. Реакции катиона хрома (III).
1) Гидрофосфат натрия.
Дает зеленоватый осадок фосфата хрома.
3+ 2-
Cr + HPO4 = CrPO4 + 8H2O
Осадок растворим в минеральных кислотах и в щелочах.
2) Окисление катиона хрома (III) пероксидом водорода.
Проводят в щелочной среде с образованием хромат иона.
3+ - 2-
2Cr + 3H2O2 + 10 OH = 2CrO4 + 8H2O
К 1-2 каплям раствора соли хрома прибавьте 3-4 капли раствора гидроксида калия и 2-3 капли 3% раствора пероксида водорода и нагрейте на водяной бане 2-3 минуты до тех пор, пока зеленая окраска раствора не перейдет в желтую, характерную для хромат иона.
3) Окисление катиона хрома (III) пермангонатом калия.
Реакция проводится в нейтральной среде с образованием дихромат-иона.
3+ - 2- +
2Cr + 2MnO4 + 5H2O = 2Mn(OH)2 + Cr2O7 + 6H
К 1-2 каплям раствора соли хрома прибавьте 2-3 капли воды и 1 каплю раствора пермангоната калия, нагрейте, отцентрифугируйте осадок. Раствор над осадком должен окраситься в желтый цвет.
4) Образование надхромовой кислоты.
При действии пероксида водорода на подкисленный раствор хромата или бихромата получается надхромовая кислота, вследствие чего раствор окрашивается в интенсивно синей цвет.
2- +
Сr2O7 + 4H2O2 + 2H = 2H2CrO6 + 3H2O
В водном растворе надхромовая кислота очень неустойчива. Она разлагается с образованием ионов хрома (III), и синяя окраска быстро переходит в зеленую. Если к раствору прилить амилоэфирную смесь, то надхромовая кислота переходит при взбалтывании в слой растворителя, что сильно повышает ее устойчивость. Данная реакция очень чувствительна и специфична, поэтому комбинируя ее с какой-либо реакцией окисления хрома (III) до хрома (VI), можно использовать эту реакцию для открытия хрома (III) в присутствии других катионов.
4. Реакции катиона цинка.
1) Гидрофосфат натрия.
Дает белый осадок фосфата цинка.
2+ 2- +
3Zn + 2HPO4 = Zn3(PO4)2 + 2H
Осадок растворим в кислотах, щелочах, аммиаке.
2) Сульфид натрия.
Дает белый осадок сульфида цинка.
2+ 2-
Zn + S = ZnS
3) Гексацианоферрат (II) калия.
Дает белый осадок гексацианоферрата (II) калия-цинка.
2+ + 4-
3Zn + 2K + 2[Fe(CN)6] = K2Zn3[Fe(CN)6]2
Осадок растворим в щелочах. Эта реакция отличает ион цинка от иона алюминия, который с данным реактивом осадка не образует.
5. Реакции катиона олова (II).
1) Хлорид ртути (II).
Окисляет ион олова (II) до иона олова (IV), с образованием белого осадка каломели.
2+ 2+ - 2-
2Hg + Sn + 8CI = [SnCI6] + Hg2CI2
Осадок быстро темнеет вследствие выделения металлической ртути.
2+ - 2-
Hg2CI2 + Sn + 4CI = [SNCI6] + 2Hg
2) Нитрат висмута.
Окисляет в щелочной среде гидроксостанниты до гидроксостаннатов. Реакции сопровождаются выпадением черного осадка висмута.
3+ 2- - 2-
2Bi + 3[Sn(OH)4] + 6OH = 2Bi + 3[Sn(OH)6]
3) Металлический цинк.
Восстанавливает ионы олова (II) до свободного металла, оседаюшего в виде серого губчатого слоя.
2+ 2+
Sn + Zn = Sn + Zn
К раствору соли олова прибавьте один кусочек цинка. Олово растворимо в соляной кислоте, поэтому при выполнении реакции раствор не должен быть слишком подкислен.
6. Реакция катиона олова (IV).
1) Металлы (AI, Mg, Fe).
Восстанавливают ионы олова (IV) до олова (II) или до металлического олова.
2- 2- 2+ -
[SnCI6] + Fe = [SnCI4] + Fe + 2CI
К 3-4 каплям раствора соли олова (IV) прибавьте 2-3 капли раствора соляной кислоты и немного железных стружек, нагрейте. Убедитесь в появлении иона олова (II) с помощью раствора хлорида ртути. Реакция используется для перевода ионов олова (IV) в олово (II), которые открываются той или иной реакцией.
 2015-05-06
2015-05-06 1356
1356








