Анализируемая смесь может представлять собой водный раствор без осадка или водный раствор с осадком. В зависимости от этого выбирают ту или иную схему систематического хода анализа.
А. Анализ раствора без осадка.
Анализируемый раствор может быть окрашенным или бесцветным.
· Если раствор прозрачный и бесцветный, то можно предположить, что он не содержит катионы Cr3+, Fe3+, Cu2+, Co2+, Ni2+.
· Водные растворы Ni2+ окрашены в зеленый цвет, Co2+ - розовый, Cu2+ - от голубой до сине-зеленой, Fe3+ - желтый или желто-бурый, Cr3+ - зеленый.
· Если значение рН раствора находится в пределах рН=2-4 (и раствор не содержит осадка), то в нем отсутствуют олово (II), олово (IV), сурьма (III), сурьма (V), висмут (III), ртуть (II), железо (III), так как в противном случае их продукты гидролиза выделялись бы в форме осадков при указанных значениях рН раствора.
Анализируемый раствор делят на три части. Одну часть используют для предварительных испытаний, другую – для проведения систематического анализа, третью – оставляют для контроля.
|
|
|
а). Отделение и открытие катионов второй аналитической группы.
Ø К 25-30 каплям анализируемого раствора прибавляют на холоду групповой реагент – раствор (2М) HCl до полного выделения осадка, состоящего из смеси хлоридов серебра AgCl, ртути (I) Hg2Cl2, и свинца PbCl2.
Ø Смесь центрифугируют и проверяют полноту осаждения хлоридов, прибавляя к прозрачному центрифугату 1-2 капли раствора HCl. Если раствор остается прозрачным, осаждение считают полным. Если же раствор мутнеет, прибавляют дополнительно HCl до полного прекращения осаждения хлоридов катионов II группы (AgCl, Hg2Cl2, PbCl2).
Ø Осадок отделяют от центрифугата, промывают HCl при перемешивании, вновь отделяют осадок от промывных вод центрифугированием, а центрифугат оставляют для дальнейшего анализа (центрифугат 1).
Отделение и открытие катионов свинца Pb2+.
Ø К осадку хлоридов серебра, ртути и свинца прибавляют небольшой объем горячей дистиллированной воды и смесь нагревают до кипения. Растворимость хлорида свинца в воде увеличивается с ростом температуры, поэтому при нагревании хлорид свинца переходит в раствор, а в осадке остаются хлориды серебра и ртути. Операцию при необходимости повторяют.
Ø Горячую смесь центрифугируют; горячий раствор, содержащий PbCl2, отделяют от осадка; и в отдельных пробах этого раствора открывают катионы свинца реакциями с дихроматом калия K2Cr2O7 в присутствии ацетата натрия CH3COONa (выпадает желтый кристаллический осадок хромата свинца PbCrO4, растворимый в щелочах и нерастворимый в уксусной кислоте) и с иодидом калия KI (выпадает желтый кристаллический осадок иодида свинца PbI2, растворимый в избытке иодида калия).
|
|
|
Отделение и открытие катионов серебра Ag+.
Ø Повторяют обработку осадка хлоридов серебра и ртути дистиллированной водой для полного удаления следов оставшегося PbCl2, в чем убеждаются реакцией с K2Cr2O7 (в пробе раствора не должен образоваться PbCrO4).
Ø Затем отделяют и открывают катионы серебра. К осадку (AgCl + Hg2Cl2) прибавляют небольшой объем раствора концентрированного аммиака (NH4OH), смесь перемешивают, слегка нагревают на водяной бане и центрифугируют. При обработке осадка аммиаком AgCl растворяется с образованием бесцветного аммиачного комплекса серебра [Ag(NH3)2]+. В осадке остается хлорид ртути (I).
Ø Смесь центрифугируют. Катионы Ag+ открывают в отдельных порциях центрифугата реакциями с концентрированной HNO3 (выпадает белый осадок AgCl – раствор мутнеет) и с раствором KI (выпадает желтый осадок AgI- раствор также мутнеет).
Открытие катионов ртути (I) Hg22+.
Ø Осадок хлорида ртути (I), оставшийся после обработки аммиаком смеси хлоридов серебра и ртути, должен почернеть, так как при реакции хлорида ртути (I) с аммиаком выделяется металлическая ртуть в тонкодисперсном состоянии, придавая осадку черный цвет:
Hg2Cl2 + 2 NH3 → HgNH2Cl (белый) + Hg (черный) + NH4Cl
Почернение осадка свидетельствует о присутствии катионов ртути (I).
б). Отделение и открытие катионов третьей аналитической группы.
Ø К 25-30 каплям анализируемого раствора прибавляют раствор серной кислоты (с добавлением этанола, если в раствор присутствуют катионы кальция). Выделяются белые осадки сульфатов катионов третьей аналитической группы – CaSO4, SrSO4, BaSO4, а также сульфат свинца PbSO4. Убеждаются в полноте осаждения катионов третьей группы (раствор не должен мутнеть при добавлении небольшого количества серной кислоты). Смесь центрифугируют, отделяют осадки сульфатов, а центрифугат оставляют для дальнейшего анализа (центрифугат 2).
Ø К осадку сульфатов прибавляют небольшое количество водного 30%-го раствора ацетата аммония CH3COONH4 или натрия CH3COONа при нагревании на водяной бане для удаления примесей сульфата свинца, который в этих условиях переходит в раствор. Операцию при необходимости повторяют до отрицательной реакции на катионы свинца (проба с K2Cr2O7 в отдельной порции раствора).
В осадке остаются сульфаты кальция, стронция и бария, которые переводят в карбонаты (растворимые в кислотах) для того, чтобы затем растворить эти карбонаты в кислоте и получить раствор, в котором содержались бы катионы Са2+, Sr2+ и Ва2+.
Для перевода сульфатов в карбонаты
Ø к осадку сульфатов прибавляют небольшое количество насыщенного водного раствора Na2CO3, смесь перемешивают и нагревают несколько минут на водяной бане. Сульфаты переходят в карбонаты.
Ø Смесь после нагревания центрифугируют, отделяют центрифугат и осадок снова обрабатывают насыщенным водным раствором Na2CO3. Операцию повторяют до отрицательной реакции на сульфат - ионы в центрифугате. Промывают осадок дистиллированной водой и к промывным водам прибавляют раствор BaCl2. Если при этом не наблюдается образование мути (BaSO4), то обработку осадка раствором соды прекращают, так как отсутствие сульфат – ионов свидетельствует о том, что сульфаты кальция, стронция и бария полностью перешли в карбонаты.
Ø Оставшийся осадок уже карбонатов Са, Sr и Ba обрабатывают раствором уксусной кислоты (2М) при нагревании. Осадок растворяется. В полученном растворе (раствор 1) затем открывают каждый катион третьей аналитической группы.
Открытие и удаление катионов бария Ва2+.
Ø К 5-7 каплям раствора 1 прибавляют 5 капель раствора K2Cr2O7 и 5 капель раствора CH3COONa. В присутствии катионов Ва2+ выпадает желтый кристаллический осадок BaCrO4.
Ø Если доказано наличие в растворе катионов бария, то их удаляют из всего раствора 1, прибавляя CH3COONa и избыток K2Cr2O7 до полного осаждения BaCrO4 (до тех пор, пока при прибавлении очередной капли раствора K2Cr2O7 не будет наблюдаться образование мути BaCrO4). Удаление катионов Ва2+ проводят для того, чтобы устранить их мешающее действие при последующем открытии катионов Са2+ и Sr2+.
|
|
|
Удаление дихромат – ионов.
Ø После осаждения BaCrO4 смесь центрифугируют и отделяют раствор от осадка. В растворе могут содержаться катионы Са2+ и Sr2+. В нем же присутствуют и дихромат – ионы, введенные на предыдущей стадии анализа. Для отделения катионов Са2+ и Sr2+ от дихромат – ионов к раствору прибавляют раствор CH3COONa до перехода окраски из желто – оранжевой в желтую. При этом выпадает осадок карбонатов Са2+ и Sr2, который отделяют от раствора центрифугированием. Осадок карбонатов промывают дистиллированной водой и обрабатывают водным 2М раствором CH3COOН до его полного растворения (раствор 2).
Открытие катионов стронция Sr2+.
Ø К 5-10 каплям раствора 2 прибавляют несколько капель гипсовой воды, нагревают на водяной бане и оставляют на несколько минут. Появление белого осадка сульфата Sr2+ (помутнение раствора) указывает на присутствие катионов Sr2+ в растворе.
Открытие катионов Са2+.
Ø Если катионы Sr2+ присутствуют в растворе, то катионы Са2+ открывают реакцией с гексацианоферратом (II) калия К4[Fe(CN)6] в присутствии NH4Cl – образуется белый осадок гексацианоферрата (II) аммония и кальция (NH4)2Ca[Fe(CN)6]. Если же катионы Sr2+ отсутствуют в растворе, то катионы кальция открывают также и реакцией с оксалатом аммония (NH4)2C2О4 – образуется белый осадок оксалата кальция СаС2О4, нерастворимый в уксусной кислоте.
Катионы Sr2+ и Ва2+ мешают открытию катионов Са2+ этой реакцией, поскольку также образуют белые осадки SrC2O4 и ВаС2О4 (первый из них частично растворим в уксусной кислоте, второй – растворяется в ней при нагревании).
в).Отделение катионов четвертой аналитической группы от катионов пятой и шестой аналитических групп.
Ø К раствору 3 (смесь центрифугата 1 и 2) медленно прибавляют водный 2М раствор NaOH до нейтральной реакции среды и затем – дополнительно избыток раствора NaOН и небольшое количество Н2О2. Нагревают смесь на кипящей водяной бане. В этих условиях катионы IV группы, образовавшие соответствующие растворимые гидроксокомплексы, остаются в растворе, а катионы V и VI аналитических групп переходят в осадок (смесь гидроксидов и основных солей).
|
|
|
Ø В случае присутствия в растворе катионов Cr3+ смесь продолжают нагревать до изменения цвета раствора из зеленого (цвет Cr3+) до желтого (цвет CrO42-). При этом весь Cr3+ окисляется до Cr6+.
Ø После нагревания (непрореагировавший раствор Н2О2 удаляется) смесь центрифугируют, осадок отделяют от центрифугата.
Ø Осадок содержит катионы V и VI групп (осадок 1), а щелочной центрифугат – катионы первой и четвертой аналитических групп (центрифугат 3).
г) Открытие катионов четвертой аналитической группы.
Ø К 15-20 каплям центрифугата 3 в фарфоровой чашке прибавляют 5-8 капель 3%-го раствора Н2О2 и 20%-й раствор NaOH при нагревании до полного растворения выпавшего осадка гидроксидов ([Zn(OH)4]2-, [Al(OH)6]2-, ([Sn(OH)6]2-, AsO43- и CrО42-). Раствор кипятят непродолжительное время для полного удаления избытка Н2О2. При наличии в центрифугате 3 катионов Cr3+ получают раствор желтого цвета (за счет образования CrО42-).
Ø К образовавшемуся раствору прибавляют малыми порциями кристаллы NH4Cl и упаривают раствор до небольшого объема. Выпадает белый осадок гидроксидов Al и олова (IV), который отделяют центрифугированием от желтого раствора. Этот осадок промывают 2-3 раза холодной водой, отделяют от промывных вод центрифугированием и растворяют в небольшом объеме горячего раствора 2М HCl. В отдельных пробах полученного солянокислого раствора (раствор 4) открывают катионы Al3+ реакцией с ализарином и олово.
Открытие катионов Al3+.
Ø 2-3 капли раствора 4 наносят в центр листа фильтровальной бумаги, пропитанной раствором гексацианоферрата (II) калия. Лист выдерживают в парах аммиака. Мешающие катионы дают темное пятно смеси гексацианоферратов (II), а катионы Al3+ образуют Al(OH)3. На влажное пятно наносят 1-2 капли раствора ализарина и снова выдерживают бумагу над парами аммиака. Образуется розовый комплекс алюминия с ализарином. Пятно смачивают несколькими каплями СН3СООН (2М) и дают возможность растворителю самопроизвольно переместиться от центра пятна к периферии. Вместе с растворителем перемещаются катионы Al3+, образующие комплекс Al с ализарином (розово-красный цвет на слабо – фиолетовом фоне). При высушивании бумаги фиолетовый фон исчезает (ализарин).
Открытие катионов олова (IV).
Ø К нескольким каплям раствора 4 прибавляют кусочек железной стружки. Через 2-3 мин. удаляют остатки металлического железа и к раствору (раствор 5) прибавляют несколько капель раствора HgCl2. Образуется белый осадок каломели Hg2Сl2, который затем темнеет за счет выделения металлической ртути в тонкодисперсном состоянии.
Для контроля олово (II) открывают также реакцией с нитратом висмута (III). К 3-5 каплям раствора 5 медленно прибавляют раствор NaOH (2М) до сильно щелочной реакции и затем 1-2 капли раствора Bi(NO3)3 (появляется черный осадок Bi0).
Желтый раствор, полученный после отделения катионов Al3+ и Sn (IV) анализируют дробным методом (раствор 6).
Открытие катионов Zn2+.
Ø R 5-10 каплям раствора 6 прибавляют ~ 10 капель раствора Н2О2 и ~ 10 капель концентрированного раствора NaOH. Полученный раствор кипятят 1-2 мин, охлаждают до комнатной температуры и прибавляют к нему 2-3 капли раствора (NH4)3S (выпадает белый осадок ZnS). А также проводят реакцию с дитизоном.
д). Разделение и открытие катионов пятой и шестой аналитических групп.
Ø Осадок 1 нейтрализуют 1М раствором Na2CO3 до начала помутнения, прибавляют 2-х-3-х кратный объем концентрированного раствора NH4OH и нагревают до 40 –500С. При этом катионы шестой группы переходят в раствор комплексных аммиакатов состава [Со (NH3)6]2+, [Ni(NH3)6]2+, [Сu(NH3)4]2+, [Сd(NH3)4]2+и [Hg(NH3)4]2+. В осадке остаются гидроксиды катионов пятой группы.
Смесь центрифугируют. Центрифугат (центрифугат 4) и осадок (осадок 2) анализируют раздельно.
Ø Осадок 2 промывают 2М раствором NH4OH, водой, растворяют в 2М растворе HNO3 и в полученном растворе открывают катионы пятой группы.
Ø Раствор обрабатывают 2М раствором аммиака до щелочной реакции среды и прибавляют кристаллический NH4Cl. Выпадают осадки Fe(OH)3 и Bi(OH)3, а катионы магния Mg2+ остаются в растворе, в пробе которого их открывают в виде магний аммоний фосфата NH4MgPO4. Для этого в пробирку вносят 2-3 капли раствора, прибавляют по 1-2 капли растворов NH4Cl, аммиака и Na2HPO4. Раствор мутнеет и образуется белый осадок NH4MgPO4.
Ø Осадок гидроксидов железа (III) и висмута (III) отделяют центрифугированием, растворяют в 2М HNO3 и в пробе полученного раствора открывают висмут реакцией с солью олова (II) – выделяется черный осадок металлического висмута.
Катионы железа были открыты в предварительных испытаниях, но при необходимости катионы Fe3+ открывают реакцией с тиоцианат – ионами (проба окрашивается в красный цвет).
Ø Аммиачный центрифугат 4, содержащий катионы шестой аналитической группы, нейтрализуют 1М раствором H2SO4 до слабо кислой реакции и в полученном растворе открывают катионы шестой группы (раствор 7).
Ø Отделение катионов ртути (II) и меди (II). К 10 –15 каплям раствора 7 прибавляют 2-3 мл 1М раствора Na2S2O3 (или небольшое количество кристаллического Na2S2O3). Смесь кипятят 2-3 мин. Из раствора выпадает осадок сульфидов ртути (II) Hg,S меди (I), Cu2S и свободной серы (осадок 3), а в растворе остаются катионы Zn2+, Cd2+, Co2+ и Ni2+ вместе с образовав-шимися S2-. Осадок отделяют от раствора центрифугированием. Обе фазы анализируют раздельно.
Ø Осадок 3 обрабатывают при нагревании 3М HNO3. HgS не растворяется, а Cu2S переходит в раствор (раствор 8) с одновременным окислением меди (I) до (II).
Ø Осадок, содержащий HgS, отделяют от раствора 8, обрабатывают при нагревании смесью (1:3) 2М раствора HCl и 3% -го раствора Н2О2. HgS растворяется. В образовавшемся растворе открывают катионы ртути (II) реакцией с хлоридом олова (II) (образуется черный осадок металлической ртути), а также реакцией с KI (выпадает оранжево-красный осадок HgI2, растворимый в избытке KI с образованием бесцветных комплексных анионов [HgI4]2-).
Ø В азотнокислом растворе 8 открывают катионы меди (II) Cu2+. К 2-3 каплям раствора 8 прибавляют несколько капель водного 2М аммиака до щелочной реакции (образуется синий аммиачный комплекс меди (II) [Cu(NH3)4]2+ и раствор окрашивается в ярко-синий цвет.
Ø Для контроля Cu2+ открывают также реакцией с гексацианоферратом (II) калия К4[Fe(CN)6]. К 2-3 каплям раствора 8 прибавляют 1-2 капли раствора К4[Fe(CN)6] (выпадает красно-коричневый осадок гексацианоферрата (II) меди (II) Cu2[Fe(CN)6]. Можно проводить на фильтровальной бумаге, пропитанной раствором К4[Fe(CN)6], - на бумаге наблюдается образование красно – коричневого пятна.
Отделение и открытие катионов цинка Zn2+.
Центрифугат 5 нагревают до кипения и кипятят до полного удаления сероводорода H2S. Полноту удаления H2S проверяют с помощью фильтровальной бумаги, пропитанной раствором соли свинца (II). При внесении бумаги в пары, образующиеся при кипении раствора, она темнеет, если пары содержат H2S, вследствие образования на бумаге черного PbS.
После полного удаления H2S из раствора к нему прибавляют 5-6 капель 6М раствора NaOH и раствор нагревают. При этом выпадают осадки гидроксидов кадмия Cd(OH)2, Co(OH)2, Ni(OH)2, а катионы цинка остаются в растворе в форме бесцветного растворимого гидроксокомплекса [Zn(OH)4]2-.
Ø Раствор отделяют от осадка (осадок 4) центрифугированием и открывают в нем катионы цинка. Для этого раствор подкисляют 2М раствором уксусной кислоты и открывают в нем катионы цинка реакцией с гексацианоферратом (II) калия – выделяется белый кристаллический осадок гексацианоферрата (II) калия и цинка состава К2Zn[Fe (CN)6].
Открытие катионов Cd2+ , Co2+ и Ni2+.
Ø Осадок 4 растворяют в разбавленной СН3СООН (или 2М HCl).
В отдельных порциях образовавшегося раствора открывают катионы Cd2+ , Co2+ и Ni2+ (раствор 9).
Катионы Cd2+ открывают реакциями с раствором тетраиодовисмутата (III) калия К[BiI4] (выпадает черный осадок BiI3), и с сероводородной водой (желтый осадок CdS), и с дитизоном (красноватое окрашивание).
Катионы кобальта (II) Co2+ открывают реакциями с раствором нитрита калия KNO2 в уксусной среде (образуется желтый кристаллический осадок гексанитрокобальтата (III) калия К3[Сo(NO2)6]) и с раствором тиоцианата аммония NH4NCS (или KNCS) в присутствии органической фазы – смеси изоамилового спирта и эфира – верхний органический слой принимает синюю окраску комплексного аниона [Со(NCS)4]2-, экстрагирующегося из водной фазы в органическую.
Катионы никеля (II) Ni2+ открывают реакцией с диметилглиоксимом в аммиачной среде (образуется красный осадок комплекса Ni2+ с диметилглиоксимом, а раствор окрашивается в розово-красный цвет).
*Открытие катионов первой аналитической группы.
Катионы первой аналитической группы, не имеющей группового реагента, обычно открывают дробным методом в отдельных небольших пробах исходного анализируемого раствора.
§3. Аналитические реакции анионов.
1. Аналитические реакции анионов первой аналитической группы: SO42-, SO32-, S2O32-, C2O42-, CO32-, B4O72-(BO2-), PO43-, AsO43-, AsO33-, F-.
Групповой реагент – водный раствор BaCl2.
Реакции с групповым реагентом проводят в нейтральной или слабо щелочной среде, так как осадки соответствующих бариевых солей малорастворимы в данных условиях.
· Осадки бариевых солей анионов I группы растворяются в минеральных кислотах, за исключением BaSO4.
· Карбонат BaCO3, тетраборат BaB4O7, ортофосфат Ba(PO4)2 и арсенат Ba3(AsO4)2 растворимы и в уксусной кислоте.
Катионы Аg+ дают осадки солей серебра с анионами I группы, за исключением фторид – аниона F-, поскольку AgF растворим в воде.
· Эти осадки растворяются в азотнокислом растворе, в отличие от солей серебра анионов второй аналитической группы.
Соли свинца анионов I группы также нерастворимы в воде, за исключением тетрабората (B4O72-) и периодата.
Анионы I группы в водных растворах бесцветны.
Анионы – окислители – AsO43-, иногда CrO42-, Cr2O72-.
Анионы – восстановители - AsO43-, S2O32-, SO32-, C2O42-.
Под действием минеральных кислот анионы «летучих» кислот (CO32-, SO32- и S2O32-) разрушаются с выделением газообразных СО2 или SO2.
1.1. Аналитические реакции сульфат – иона SO42-.
Сульфаты аммония и многих металлов хорошо растворяются в Н2О. Сульфаты кальция, стронция, бария, свинца (II) малорастворимы в воде, что широко используется в химическом анализе.
1. Реакция с катионами бария (фармакопейная).
Ва2+ + SO42- → BaSO4↓ (белый мелкокристаллический)
Признаки реакции: Выпадает белый осадок сульфата бария. Если в растворе присутствует перманганат калия КМО4, то осадок BaSO4 окрашивается в фиолетово – красный цвет за счет адсорбции MnO4- - ионов на осадке.
· BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной Н2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
ВаSO4 + Н2SO4 → Ba(НSO4)2
2. Реакция с катионами свинца.
Pb2+ + SO42- → PbSO4↓ (белый кристаллический)
· Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия СН3СООNa или аммония СН3СООNН4 с образованием комплексных соединений:
PbSO4 + 4 NaOH → Na2[Pb(OH)4] + Na2SO4
3. Реакция с родизонатом бария.
O O







 О || O O || O
О || O O || O


Ва + SO42- → ВаSO4 ↓(белый) +







 О || О O || O
О || О O || O
О O
Родизонат бария (красный) родизонат – анион (бесцветный)
Признаки реакции. На фильтровальной бумаге возникает красное пятно родизоната бария, обесцвечивающееся при нанесении на пятно раствора, содержащего сульфат – ионы (Na2SO4, K2SO4 или Н2SO4 разбавленной).
1.2. Аналитические реакции сульфит – иона SO32-.
В водных растворах сульфит – ионы бесцветны, подвергаются гидролизу, являются сильными восстановителями (уже в водных растворах они медленно окисляются кислородом воздуха до сульфатов). Сульфит – ион обладает довольно эффективными комплексообразующими свойствами как лиганд.
Средние сульфиты натрия и калия хорошо растворяются в воде, средние сульфиты других металлов, как правило, малорастворимы в воде.
При действии кислот на сульфиты они разлагаются.
1. Реакция с хлоридом бария (фармакопейная).
Ва2+ + SO32- → BaSO3↓(белый кристаллический)
Аналогично протекает реакция сульфит – ионов и с хлоридом стронция SrCl2.
· Осадок растворяется в разбавленных НСl и HNO3 с выделением газообразного диоксида серы SO2:
BaSO3 + 2 НСl → SO2↑ + ВаCl2 + Н2О
2. Реакция с нитратом серебра.
2 Ag+ + SO32- → Ag2SO3↓(белый)
· Осадок растворяется при избытке сульфит – ионов с образованием растворимых комплексных дисульфитоаргентат (I) – ионов [Ag(S2O3)2]3-:
Ag2SO3 + 3 SO32- → 2 [Ag(SO3)2]3-
В другой пробирке аналогично получают белый осадок сульфита серебра и кипятят смесь осадка с раствором. Осадок постепенно темнеет, за счет выделения оксида серебра Ag2O:
Ag2SO3 → Ag2O + SO2
3. Реакция разложения сульфитов кислотами (фармакопейная).
SO32- + 2 Н+ → SO2↑ + Н2О
Выделяющийся диоксид серы SO2 обнаруживают по характерному запаху, а также по обесцвечиванию водного раствора йода или перманганата калия:
SO2 + I2 + 2 H2O → H2SO4 + 2 HI
5 SO2 + 2 KMnO4 + 2 Н2О → K2SO4 + 2 MnSO4 + 2 H2SO4
Разложение сульфитов под действием кислот ускоряется при нагревании и при понижении рН среды.
4. Реакция с перманганатом калия.
5 SO32- + 2 MnO4- + 6 Н+ → 2 Mn2+ + 5 SO42- + 3 H2O
В кислой среде сульфит – ионы окисляются до сульфат – ионов, при этом розовый раствор перманганата калия обесцвечивается.
В нейтральной среде сульфит – ион при реакции с MnO4- - ионом также окисляется до сульфат – иона, при этом кроме обесцвечивания образуется темный хлопьевидный осадок MnO(OH)2:
3 SO32- + 2 MnO4- + 3 H2O → 2 MnO(OH)2 + 3 SO42- + 2 ОН-
5. Реакция с раствором йода (фармакопейная).
SO32- +I2 (желто-бурый) + H2O → SO42- + 2 I- (бесцветный) + 2 Н+
Реакцию проводят в нейтральных или слабо кислых растворах.
6. Реакция восстановления сульфит – иона металлическим цинком в кислой среде.
SO32- + 2 Н+ → SO2 + Н2О
SO2 + 3 Zn + 6Н+ → H2S + 3 Zn2+ + 2 H2O
Признаки реакции: полоска фильтровальной бумаги, смоченная раствором соли свинца чернеет:
H2S + Pb2+ → PbS + 2 H+
Сульфит – ион в растворах можно открыть также другими реакциями: с красителями (фуксин, малахитовый зеленый) – обесцвечивание красителя;
с дихроматом калия – обесцвечивание раствора; с нитропруссидом натрия Na2[Fe(CN)5NO] – розово – красное окрашивание и др.
1.3. Аналитические реакции тиосульфат – иона S2O32-.
Тиосульфат – ион S2O32- - анион неустойчивой двухосновной тиосерной кислоты Н2S2O3 средней силы, которая в водных растворах разлагается с выделением элементной серы:
Н2S2O3 → S + SO2 + H2O
В водных растворах S2O32- - ион бесцветен, практически не гидролизуется, является сильным восстановителем и достаточно эффективным лигандом – комплексообразователем.
Тиосульфаты щелочных металлов, стронция, цинка, кадмия, железа (II), кобальта (II), никеля (II), марганца (II) растворимы в воде, а остальных металлов малорастворимы в воде.
1. Реакция с хлоридом бария.
Ва2+ + S2O32- → BaS2O3↓(белый мелкокристаллический)
· Осадок растворяется в кислотах с разложением:
BaS2O3 + 2 Н+ → Ва2+ + S + SO2 + H2O
2. Реакция разложения тиосульфатов кислотами (фармакопейная).
При действии минеральных кислот на тиосульфаты вначале образуется нестабильная тиосерная (серноватистая) кислота Н2S2O3, быстро разлагающаяся с выделением газообразного диоксида серы SO2 и элементной серы S, которая вызывает помутнение раствора:
SO32- + 2 Н+ ↔ Н2S2O3
Н2S2O3 → S↓ + SO2↑ + H2O
Выделяющийся SO2 обнаруживают либо по характерному запаху, либо по обесцвечиванию им растворов KMnO4 или йода.
3. Реакция с йодом.
2 S2O32- + I2 → S4O62- + 2 I-
Эта реакция имеет большое значение в количественном титриметрическом анализе.
4. Реакция с нитратом серебра (фармакопейная).
2 Ag+ + S2O32- → Ag2S2O3↓(белый)
Осадок Ag2S2O3 быстро разлагаются до черного Ag2S. Цвет осадка последовательно изменяется на желтый, бурый и под конец – на черный:
Ag2S2O3 + Н2О → Ag2S + Н2SO4
При избытке S2O32- - ионов осадок Ag2S2O3 растворяется с образованием комплексных дитиосульфатоаргентат (I) – ионов [Ag(S2O3)2]3-:
Ag2S2O3 + 3 S2O32- → 2 [Ag(S2O3)2]3-
5. Реакция с сульфатом меди (II).
2Cu2+ + 3 S2O32- → Cu2S2O3 + S4O62-
Cu2S2O3 + H2O → Cu2S↓(черный) + H2SO4
С FeCl3 образует тиосульфатный комплекс [Fe(S2O3)2]- - фиолетового цвета (постепенно разлагающийся в водном растворе), с солями ртути (II) – черный осадок сульфида ртути (II) HgS; легко окисляется различными окислителями (Н2О2, К2Cr2O7 и другие).
1.4. Аналитические реакции оксалат – иона С2O42-.
Оксалат – ион С2О42- - анион двухосновной щавелевой кислоты Н2С2О4 средней силы, сравнительно хорошо растворимой в воде. Оксалат – ион в водных растворах бесцветен, частично гидролизуется, сильный восстановитель, эффективный лиганд – образует устойчивые оксалатные комплексы с катионами многих металлов. Оксалаты щелочных металлов, магния и аммония растворяются в воде, а других металлов мало растворимы в воде.
1. Реакция с хлоридом бария.
Ва2+ + С2О42- → ВаС2О4↓(белый)
· Осадок ВаС2О4 растворяется в минеральных кислотах и в уксусной кислоте (при кипячении):
2. Реакция с хлоридом кальция (фармакопейная).
Са2+ + С2О42- → СаС2О4↓(белый)
· Осадок растворяется в минеральных кислотах, но не растворяется в уксусной кислоте.
3. Реакция с нитратом серебра.
2 Ag+ + С2O42- → Ag2С2O4↓(белый творожистый)
· Проба на растворимость. Осадок делят на 3 части:
а). В первую пробирку с осадком прибавляют по каплям при перемешивании раствор НNO3 до растворения осадка;
б). Во вторую пробирку с осадком прибавляют по каплям при перемешивании концентрированный раствор аммиака до растворения осадка;
в). В третью пробирку с осадком прибавляют 4-5 капель раствора НСl; в пробирке остается белый осадок хлорида серебра:
Ag2С2O4 + 2 НСl → 2 АgСl↓(белый) + Н2С2O4
4. Реакция с перманганатом калия.
Оксалат ионы с KMnO4 в кислой среде окисляются с выделением СО2; раствор KMnO4 при этом обесцвечивается вследствие восстановления марганца (VII) до марганца (II):
5 С2O42- + 2 MnO4- + 16 Н+ → 10 СО2 + 2 Mn2+ + 8 H2O
Признаки реакции: Разбавленный раствор KMnO4 обесцвечивается; наблюдается выделение пузырьков газа – СО2.
1.5. Аналитические реакции карбонат – иона СO32-.
Карбонаты – соли нестабильной, очень слабой угольной кислоты Н2СО3, которая в свободном состоянии в водных растворах неустойчива и разлагается с выделением СО2:
Н2СО3 → СО2↑ + Н2О
Карбонаты аммония, натрия, рубидия, цезия растворимы в воде.
Карбонат лития в воде мало растворим. Карбонаты остальных металлов мало растворимы в воде. Гидрокарбонаты растворяются в воде. Карбонат – ионы в водных растворах бесцветны, подвергаются гидролизу. Водные растворы гидрокарбонатов щелочных металлов не окрашиваются при прибавлении к ним капли раствора фенолфталеина, что позволяет отличить растворы карбонатов от растворов гидрокарбонатов (фармакопейный тест).
1. Реакция с хлоридом бария.
Ва2+ + СО32- → ВаСО3↓(белый мелкокристаллический)
Аналогичные осадки карбонатов дают катионы кальция (СаСО3) и стронция (SrCO3). Осадок растворяется в минеральных кислотах и в уксусной кислоте. В растворе H2SO4 образуется белый осадок BaSO4.
· К осадку медленно, по каплям прибавляют раствор HCl до полного растворения осадка:
ВаСО3 + 2 HCl → ВаСl2 + СО2↑ + H2O
2. Реакция с сульфатом магния (фармакопейная).
Mg2+ + CO32- → MgCO3↓(белый)
Гидрокарбонат – ион НСО3- образует с сульфатом магния осадок MgCO3 только при кипячении:
Mg2+ + 2 НCO3- → MgCO3 + СО2↑ + Н2О
· Осадок MgCO3 растворяется в кислотах.
3. Реакция с минеральными кислотами (фармакопейная).
CO32- + 2 Н3О+ = Н2СО3 + 2 Н2О
НCO3- + Н3О+ = Н2СО3 + Н2О
Н2СО3 → СО2↑ + Н2О
Признаки реакции: Выделяющийся газообразный СО2 обнаруживают по помутнению баритоновой или известковой воды в приборе для обнаружения газов.
4. Реакция с гексацианоферратом (II) уранила.
2СО32- + (UO2)2[Fe(CN)6](коричневы)→ 2 UO2CO3 (бесцветный) + [Fe(CN)6]4-
Коричневый раствор гексацианоферрата (II) уранила получают, смешивая раствор ацетата уранила (СН3СОО)2UO2 c раствором гексацианоферрата (II) калия:
2 (СН3СОО)2ГО2 + К4[Fe(CN)6]→ (UO2)2[Fe(CN)6] + 4 CH3COOK
К полученному раствору прибавляют по каплям раствор Na2CO3 или К2СО3 при перемешивании до исчезновения коричневой окраски.
5. Раздельное открытие карбонат – ионов и гидрокарбонат – ионов реакциями с катионами кальция и с аммиаком.
Если в растворе одновременно присутствуют карбонат – ионы и гидрокарбонат – ионы, то каждый из них можно открыть раздельно.
Для этого вначале к анализируемому раствору прибавляют избыток раствора СаСl2. При этом СО32- осаждаются в виде СаСО3:
СО32- + Са2+ → СаСО3
Гидрокарбонат – ионы остаются в растворе, так как Са(НСО3)2 растворами в воде.
Осадок отделяют от раствора и к последнему добавляют раствор аммиака. НСО2- - анионы с аммиаком и катионами кальция дают снова осадок СаСО3:
НСО3- + Са2+ + NH3 → CaCO3 + NH4+
Карбонат – ионы при реакции с хлоридом железа (III) FeCl3 образуют бурый осадок Fe(OH)CO3, с нитратом серебра – белый осадок карбоната серебра Ag2CO3, растворимый в HNO3 и разлагающийся при кипячении в воде до темного осадка Ag2O и СО2: Ag2CO3 → Ag2O + СО2
1.6. Аналитические реакции борат – ионов В4О72- и ВО2-.
Тетраборат – ион В4О72- - анион слабой двухосновной тетраборной кислоты Н2В4О7, которая в свободном состоянии неизвестна, но может существовать в растворах. В водных растворах бесцветен, подвергается глубокому гидролизу.
Метаборат – ион ВО2- (борат – ион) - анион не существующей в растворах метаборной кислоты НВО2. Метаборат – ион в водных растворах бесцветен, подвергается гидролизу. Метаборат –ион как и тетраборат – ион не обладает окислительно–восстановительными свойствами, обладает умеренной комплексообразующей способностью как лиганд.
Применяемая на практике борная кислота – это трехосновная ортоборная кислота Н3ВО3(или В(ОН)3). Борная кислота хорошо растворяется в воде и в водных растворах, является очень слабой кислотой.
В водных растворах тетра -, орто- и метаборная кислоты находятся в равновесии:
Н2В4О7 + 5 Н2О ↔ 4Н3РО3 ↔ 4 НВО2 + 4 Н2О
Бораты аммония и щелочных металлов растворимы в Н2О. Бораты других металлов малорастворимы в воде. Из боратов наибольшее практическое значение имеет декагидрат тетрабората натрия Na2B4O7×10 H2O – белое кристаллическое вещество называемое бурой. Бура применяется в качественном анализе для открытия металлов по образованию окрашенных плавов – «перлов» буры, а также в количественном титриметрическом анализе как первичный стандарт.
1. Реакция с хлоридом бария.
В4О72- + Ва2+ + 3 Н2О → Ва(ВО2)2 + 2 Н3ВО3
· Осадок растворяется в азотной и уксусной кислотах.
2. Окрашивание пламени горелки сложными эфирами борной кислоты (фармакопейный тест).
Борат – ионы или борная кислота образуют с этанолом С2Н5ОН в присутствии Н2SО4 сложный этиловый эфир борной кислоты (С2Н5О)3В, который окрашивает пламя в зеленый цвет.
В4О72- + 2 Н+ + 5 Н2О = 4 Н3ВО3
Н3ВО3 + 3 С2Н5ОН = (С2Н5О)3В +3 Н2О
3. Реакция с куркумином (фармакопейная).
Краситель куркумин (желтого цвета) в растворах может существовать в двух таутомерных формах – кетонной и енольной, находящихся в равновесии:


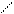 ОСН3 ОСН3
ОСН3 ОСН3


 О = С – СН =СН – ОН НО – С – СН = СН - ОН
О = С – СН =СН – ОН НО – С – СН = СН - ОН
| ||
СН2 ↔ СН
 | |
| |



 О = С – СН = СН ОН О = С – СН = СН - ОН
О = С – СН = СН ОН О = С – СН = СН - ОН
 | |||
 | |||
ОСН3 ОСН3
 2015-05-06
2015-05-06 6721
6721
