Аминокислоты в организме подвергаются разнообразным превращениям, многие из которых являются едиными для всех аминокислот — это дезаминирование, переаминирование, декарбоксилирование. Кроме того, каждая аминокислота имеет свои индивидуальные пути обмена. Эти процессы протекают внутри клетки, им подвержены аминокислоты, которые не участвуют в биосинтезе белка.
Дезаминирование — это процесс необратимого отщепления аминогруппы от аминокислот с образованием аммиака и альфа-кетокислоты (безазотистый остаток). Этот процесс является основным способом расщепления аминокислот в организме и осуществляется при участии ферментов дегидрогеназ (оксидаз). Дезаминирование может происходить несколькими путями: восстановительным, гидролитическим, внутримолекулярным и окислительном. У человека и животных преобладают внутримолекулярное и окислительное дезаминирование.
Наиболее активно окислительному дезаминированию подвергается глутаминовая кислота, что связано с высокой активностью фермента глутаматдегидрогеназы (глутамат-оксидазы), которая обнаружена почти во всех тканях.
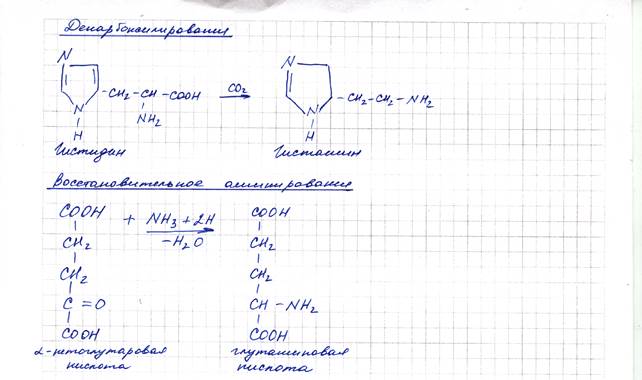
В качестве безазотистого остатка при этом образуется альфа-кетоглутаровая кислота. Глутаматдегидрогеназа катализирует как прямую, так и обратную реакцию, т. е. обладает обратимостью действия. Обратная реакция синтеза глутаминовой кислоты из аммиака и альфа-кетоглутаровой кислоты носит название восстановительного аминирования.
Переаминирование — это процесс обратимого переноса аминогруппы от аминокислот на кетокислоту без освобождения аммиака. В реакциях переаминирования образуются новые аминокислоты и кетокислоты. Главным акцептором аминогрупп от разных аминокислот является альфа-кетоглутаровая кислота, а сама в процессе переаминирования превращается в глутаминовую кислоту. Этот процесс катализируется аминотрансферазами (трансаминазами), коферментом которых является витамин В6 (фосфопиридоксаль).
При недостатке В6 активность трансаминаз снижается, при избытке — увеличивается. Из всех трансаминаз в клинической диагностике применяются аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ).
АСТ катализирует процесс переноса аминогруппы с аспарагиновой кислоты на альфа-кетоглутаровую, при этом образуются глутаминовая и щавелево-уксусная кислоты.
АЛТ обеспечивает переаминирование в реакциях с участием аланина, альфа-кетоглутаровой, глутаминовой и пировиноградной кислот.
Процесс переаминирования проходит в два этапа. На первом этапе аминотрансфераза отщепляет аминогруппу от аминокислоты, которая при этом превращается в альфа-кетокислоту, а аминная группа присоединяется к коферменту. На втором этапе кофермент переносит эту группу на другую альфа-кетоглутаровую кислоту, которая превращается в новую аминокислоту, а кофермент восстанавливается в свою исходную форму.
Переаминированию подвергаются практически все аминокислоты, за исключением лизина, аргинина и треонина. Этот процесс имеет свои особенности: отщепляемые от аминокислот аминогруппы могут переносится только на альфа-кетоглутаровую или альфа-кетоянтарную (щавелево-уксусную) кислоты, которые являются дикарбоновыми с образованием соответственно глутаминовой и аспарагиновой аминокислот. Следовательно, обязательными участниками переаминирования являются дикарбоновые аминокислоты. Процесс переаминирования для организма является основным путем синтеза заменимых аминокислот из соответствующих им альфа-кетокислот. Значительная часть альфа-кетокислот являются промежуточными продуктами обмена углеводов (например ПВК), используемая для синтеза аланина.
Переаминирование активно протекает в различных тканях организма, но при некоторых заболеваниях процесс нарушается вследствие снижения активности аминотрасфераз. Поэтому определение активности некоторых аминотрансфераз в сыворотке крови важно в клинике, что в первую очередь относится к глутаматщевелевоуксусной аминотрансферазы (ГЩУТ) и глутаматпировиноградной аминотрансферазы (ГПТ).
Фермент ГЩУТ обеспечивает синтез аспаргиновой кислоты из щавелево-уксусной за счет аминогруппы глутаминовой кислоты, а ГПТ катализирует образование аланина из пировиноградной кислоты (ПВК). При инфаркте миокарда в сыворотке крови повышается активность ГЩУТ, а при заболеваниях печени — активность ГПТ.
Непрямое дезаминирование является общим процессом для обмена всех аминокислот кроме глутаминой (она подвергается прямому окислительному дезаминированию).
Этот процесс включает два этапа: переаминирование и последующее окислительное дезаминирование.
На первом этапе аминокислота вступает в реакцию переаминирования с альфа-кетоглутаровой кислотой, которой передает аминогруппу, при этом образуется глутаминовая кислота.
На втором этапе образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию, в результате чего выделяется аммиак. Вступившая в реакцию аминокислота превращается в свою кетоформу.
Декарбоксилирование — это процесс отщепления углекислого газа от карбоксильной группы аминокислот под действием декарбоксидаз с образованием соответствующих аминов. Эти соединения обладают сильным биологическим действием на организм и поэтому называются биогенными аминами. Свое действие они проявляют в свободном виде, в организме находятся в связанной форме, из которой они освобождаются по мере необходимости, после чего быстро разрушаются в печени ферментами моноаминоксидазами.
Например, гистамин вызывает расширение капилляров и повышение их проницаемости, сужение крупных сосудов, сокращение гладкой мускулатуры внутренних органов, усиливают секрецию соляной кислоты в желудке. Серотонин (производное триптофана) способствует повышение кровяного давления и сужению бронхов, является медиатором ЦНС.

 2015-04-30
2015-04-30 4393
4393
