Фрагмент ряда селективности катионитов: Ca2+>Mg2+>K+>NH4+>Na+
Фрагмент ряда селективности анионитов: SO42->NO3->Cl->HCO3->HSiO3-
Эти ряды обозначают:
1. Каждый предыдущий элемент ряда извлекается ионитом легче и в большем количестве;
2. Каждый последующий элемент ряда, ранее поглощенный ионитом, вытесняется из него всеми предыдущими.
77. Чем обусловлена жесткость воды? Какую жесткость воды различают? Почему жесткость является нормируемым технологическим показателем?
Жесткость воды является одним из наиболее важных показателей качества воды, используемой на тепловых электростанциях. Общая жесткость волы ЖО равна сумме концентраций в пей катионов кальция (кальциевая жесткость ЖСа) и магния (магниевая жесткость ЖМg) и выражается в мнллиграмм-эквивалентах на килограмм (мг-экв/кг) нли грамм-эквивалентах на тонну (г-экв/т).
Общая жесткость воды подразделяется на карбонатную и некарбонатную. Карбонатная жесткость воды ЖК в основном обусловливается присутствием в воде бикарбонатов кальция и магния Са(МС03)2 и Mg(HCO3)2, так как СаСО3 в и MgCO3 малорастворимы в воде. В том случае, когда концентрация ионов НСО3, выраженная в мг-экв/кг.
|
|
|
Некарбонатная жесткость воды ЖНК обусловлена наличием в воде хлоридов, сульфатов и других некарбонатных солей кальция и магния: СaCl2, Mg Cl2, CaSO4, MgSO4, CaSiO3, MgSiO3.
Таким образом, общая жесткость воды равна сумме кальциевой и магниевой жесткостей, с одной стороны, и сумме карбонатной н некарбонатной жесткостей с другой.
Природная вода классифицируется по величине общей жесткости Ж0, мг-экв/дм3:
малая (очень мягкая вода), Ж0 < 1,5; средняя, Ж0 < (1,5-3,0); повышенная, Ж0 = (3,0—6,0); высокая, Ж0 = (6,0-12,0); очень высокая, Ж0 > 12,0.
78. Объяснить, почему примеси, находящиеся в коллоидно-дисперсном состоянии не могут образовывать крупные агрегаты?
Коллоиднодисперсные вещества (10-6 и 10-4 мм) по размерам частиц занимают промежуточное положение между грубодис-псрснымн и молекулярнодисперспыми. Они свободно проходят через бумажный фильтр, но не проникают через ультрапоры животных и растительных мембран. Коллоидные частицы не осаждаются даже а течение весьма длительного времени. В природных водах в коллоидно-дисперсном состоянии находятся соединения кремния, алюминия, железа, а также органические вещества, образующиеся в результате распада животных и растительных организмов.
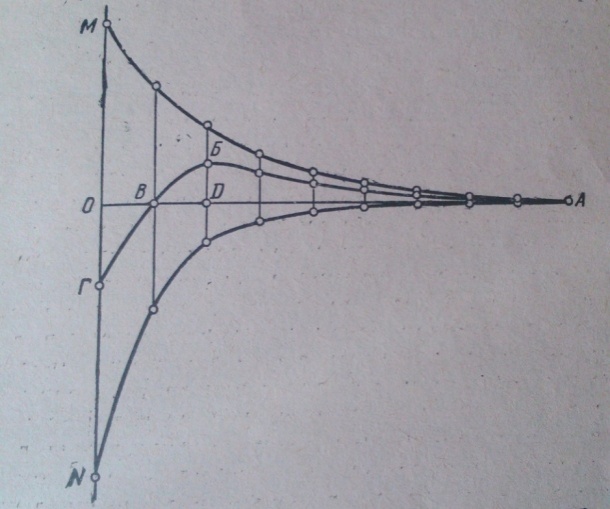
Зависимость, взаимодействия сил отталкивания и притяжения от расстояния между коллоидными частицами. - ОА - расстояниё между коллойдными частйцами; AM - кривая отталкивания; AN - кривая притяжения; АБВГ - результирующая кривая взаимодействия коллоидных частиц; БД силовой барьер.
|
|
|
Коллоидные частицы, содержащиеся в воде, находятся в непрерывном и беспорядочном броуновском движении. Между ними действуют силы взаимного притяжения и отталкивания. Силы взаимного отталкивания объясняются тем, что однородные коллоидные частицы имеют электрические заряды одного знака. Наличие электрических зарядов объясняется следующими причинами. Каждая коллоидная частица обладает весьма значительной адсорбционной способностью, благодаря чему она адсорбирует из раствора ионы электролитов одного знака, которые распределяются равномерно по ее поверхности, образуя адсорбционный слон. Коллоидная частица вместе с адсорбционным слоем называется гранулой. Ввиду наличия у гранулы электрического заряда вокруг нее концентрируются ноны с зарядами противоположного знака (противоионы). Противоионы не связаны прочно с гранулой; они сохраняют способность к диффузии в окружающую жидкость, образуя вокруг гранулы диффузный слой, в котором концентрация противоионов уменьшается по мере удаления от гранулы. Гранула вместе с диффузным слоем называется мицеллой.
При броуновском движении вместе с коллондиой частицей движется двойной электрический слой, состоящий из ионов адсорбционного слоя и части противонноп диффузного слоя, содержащихся в оболочке воды, окружающей частицу. Остальные противоионы, расположенные вокруг двойного электрического слоя, отрываются от движущей частицы. Благодаря этому последняя, потеряв часть противоионов, приобретает некоторый заряд, одинаковый по знаку с зарядом гранулы, но меньший по сравнению с ним по величине. Граница между двойным слоем и остальной частью диффузного слоя называется поверхностью скольжения коллоидной частицы в растворе.
Так как однородные частицы имеют на поверхности скольжения заряды одного знака, то между ними действуют силы взаимного отталкивания, которые так же как и силы взаимного притяжения, уменьшаются с увеличением расстояния между частицами. При уменьшение расстояния между частицами сначала действует результирующая сила взаимодействия отталкивания, возрастающая до своей максимальной величины в точке Б, после которой она уменьшается в точке В, а затем результирующая сила взаимного притяжения, возрастающая до своей наибольшей величины в точке Г при расстояние между частицами равном нулю. Для того чтобы произошла взаимное притяжение и слипание движущихся частиц, последние должны преодолеть максимальную результирующую силу отталкивания — «силовой барьер» БД. Чем выше «силовой барьер», тем труднее его преодолеть и вызвать коагуляцию. Чем меньше величина электрических зарядов, тем меньше сила взаимного отталкивания, тем ниже «силовой барьер». Снижение величины зарядов частиц может быгь достигнуто увеличением концентрации противоионов в растворе путем добавления к последнему соответствующих электролитов.
79. Перечислите известные методы снижения щелочности природных вод. Приведите пример.
Один из методов снижение щелочности является Н-катионированияе. Обработка воды путем водород-катионирования состоит в фильтровании ее через слой катионита, содержащего в качестве обменных ионов катионы водорода.
2RH+Ca(HCO3)2 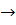 R2Ca+2H2O+2CO2;
R2Ca+2H2O+2CO2;
2RH+ Mg(HCO3)2 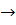 R2Mg+2H2O+2CO2;
R2Mg+2H2O+2CO2;
2RH+CaCl 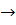 R2Ca+2HCl;
R2Ca+2HCl;
2RH+MgCl 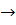 R2Mg+2HCl;
R2Mg+2HCl;
2RH+MgSO4 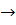 R2Mg+ H2SO4;
R2Mg+ H2SO4;
2RH+NaSO4 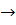 2RNa+ H2SO4;
2RNa+ H2SO4;
В результате обмена катионов фильтрат получается мягким, но кислым, образуются все кислоты, как сильные так и слабые. Щелочность уменьщается. Основным недостатком метода является наличие кислого фильтрата.
Чаще всего для умягчение и снижение щелочности применяют параллельное H-Na-катионирование и последовательное H-Na – катионирование.
80. Что такое кремнеемкость? Почему для обескремнивания воды применяют высокоосновные аниониты? С каким процессом это связано?
|
|
|
Так как сильноосновные аниониты в схемах полного химического обессоливания предназначены для обескремнивания, их обменная способность характеризуется рабочей кремнеемкостью, выраженной количеством грамм-эквивалентов HSiO3 которое может извлечь из воды 1 м3 набухшего анионита в результате обменной реакции. Рабочая кремнеемкость сильноосновных анионитов зависит от величины pH воды, поступающей на анионитный фильтр, концентрации кремниевой кислоты в этой воде, удельного расхода щелочи на регенерацию, концентрации регенерирующего раствора, момента отключения фильтра на регенерацию, скорости фильтрования соды, природы обменного иона (OH-, НСO3, 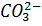 ), температуры исходной воды и других факторов.
), температуры исходной воды и других факторов.
Сильноосновные анионы способны извлекать из воды анионы как сильных (Сl., SO42, NO3, так и слабых (НСО3-, HSiO3) кислот в широкой области значений pH, к ним относятся аниониты марки АН-18, АН-31 и другие.
Из новых сильноосновных анионитов наибольшее распространение получил внионит марки АВ-17. От слабоосновных анионитов он отличается тем, что содержит исключительно сильно диссоциированные активные аминогруппы четвертичного аммониевого основания. Анионит АВ-17 хорошо сорбирует слабые кислоты, в том число кремниевую. Анионит АВ-17 механически прочен и химически стоек к кислотам и щелочам. Он применяется в основном для улалеиня из воды кремниевой кислоты в схемах полного химического обессоливания.
Глубокое обескремнивание и высокая кремнеемкость анионитов достигаются лишь при определенных значениях рН фильтруемой воды. Лучшие результаты получаются в том случае, когда в исходной воде находится сама кремниевая кислота, а не ее соли.
Степень влияния солей, присутствующих в исходной воде, на снижение кремнеемкости анионитов и остаточное содержание кремниевой кислоты в фильтрате различна. Она уменьшается с ростом силы основности анионитов. Однако и для использования этих анионитов по прямому назначению (поглощение кремниевой кислоты) лучшие условия создаются при отсутствии солей в исходной воде.
|
|
|
81. Чем обусловлена общая щелочность воды? Чему принимаеться равной общая щелочность природной воды?
Под щелочностью природных или очищенных вод понимают способность некоторых их компонентов связывать эквивалентное количество сильных кислот. Щелочность обусловлена наличием в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов). Их сумма называется общей щелочностью. Ввиду незначительной концентрации трех последних ионов общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы, гидролизуясь, образуют гидроксид-ионы:
CO32- + H2O <=> HCO3- + OH-
HCO3- + H2O <=> H2CO3 + OH-
 2015-05-14
2015-05-14 1606
1606








