1) растворимые соли могут реагировать с металлами:
2AgNO3 + Cu ® 2Ag + Cu(NO3)2
2) некоторые соли могут окисляться активными неметаллами:
2KI + Cl2 ® 2KCl + I2
3) растворимые соли могут реагировать с растворами щелочей:
Fe(NO3)3 + 3NaOH ® Fe(OH)3¯ + 3NaNO3
4) соли слабых кислот реагируют с сильными кислотами:
Na2SiO3 + 2HCl2 ® H2SiO3¯ + 2NaCl
5) в растворе соли могут реагировать между собой:
BaCl2 + Na2SO4 ® BaSO4¯ + 2NaCl,
AgNO3 + NaCl ®AgCl¯ + NaNO3
6) некоторые соли при нагревании легко разлагаются:
2KNO3 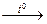 2KNO2 + O2,
2KNO2 + O2,
MgCO3 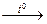 MgO + CO2,
MgO + CO2,
7) соли, имеющие в своём составе катион слабого основания или анион слабой кислоты, подвергаются гидролизу:
Al2S3 + 6H2O 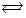 2Al(OH)3¯ + 3H2S
2Al(OH)3¯ + 3H2S
FeCl3 + H2O 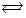 Fe(OH)Cl2 + HCl
Fe(OH)Cl2 + HCl
Na2S + H2O 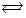 NaHS +NaOH
NaHS +NaOH
8) некоторые соли вступают в окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl ® 2MnCl2 + 2KCl + 5Cl2 + 8H2O
 2015-05-18
2015-05-18 262
262








