Пример 1. Реакция между веществами А и В протекает по уравнению 2А + В = С, концентрации веществ (моль/л) равны [А] = 6, [В] = 5. Константа скорости реакции равна 0,5 л2 × моль-2 × с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
Решение. Согласно закону действующих масс, скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Следовательно, для реакции 2А + В 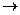 С
С
V = k СА2 СВ.
Скорость химической реакции в начальный момент равна:
V1 = 0,5 · 62 · 5 = 90 моль·с-1·л-1.
Если изменилась концентрация хотя бы одного из реагирующих веществ, то изменится концентрация и всех остальных веществ:
По истечении некоторого времени в реакционной смеси остается 45% вещества В, т.е. [В] = 5 · 0,45 = 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 − 2,25 = 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль (2,752) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно,
|
|
|
V2 = 0,5 ∙ (0,5)2 · 2,25 = 0,28 моль · с-1 · л-1.
Пример 2. Определите, как изменится скорость прямой реакции
2СО(г) + О2(г) = 2CO2(г), если общее давление в системе увеличить в 4 раза.
Решение. Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрации реагирующих веществ возрастут в 4 раза. Согласно закону действующих масс начальная скорость реакции равна
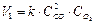
После увеличения давления
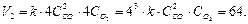
Следовательно после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Примечание. Закон действия масс в его классической форме (выраженной через концентрации) справедлив для неэлектролитов и разбавленных растворов слабых электролитов (т.е. для газов и растворов). Твердые вещества в выражение для скорости реакции не включают, так как для них понятие концентрации неприемлемо; скорость реакций в твердой фазе зависит от площади поверхности твердого вещества, т.е. степени его измельчения.
Так, для реакции С(т) + СО2(г) = 2СО(г) скорость прямой реакции 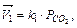 обратной
обратной 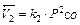 .
.
Изменение давления смещает равновесие, если число молей исходных и образующихся газообразных веществ неодинаково. Для реакции 2СО + O2 = 2CO2 скорость прямой реакции 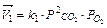 , обратной
, обратной 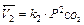 .
.
Пример 3. В системе А(г) + 2В(г) = С(г) равновесные концентрации равны: [А] = 0,06 моль/л; [В] =0,12 моль/л; [С] = 0,216 моль/л. Найдите константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Согласно закону действия масс, константа равновесия данной реакции выражается уравнением
|
|
|
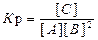 .
.
Подставляя в него данные задачи, получаем:
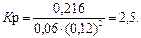
Согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль вещества С, то при этом было израсходовано 0,216 моль А и 0,216·2 = 0,432 моль В. Таким образом, искомые исходные концентрации равны:
[А] = 0,06 + 0,116 = 0,276 моль/л;
[B] = 0,12 + 0,432 = 0,552моль/л.
Пример 4. Реакция протекает по уравнению А + В = 2С. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции К р = 50.
Решение. К моменту равновесия концентрации исходных веществ А и В понизятся, а концентрация продукта реакции С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через х моль, то увеличение концентрации вещества С будет равно 2 х моль.
Равновесные концентрации реагирующих веществ будут:
[А] = (0,5 – х) моль/л; [В] = (0,7 – х) моль/л; [С] = 2 х моль/л.
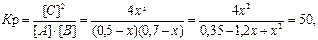
46 x2 – 60 x + 17,5=0.
Решая уравнение, получаем: x1 = 0,86; х2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [А] = 0,5 – 0,44 = 0,06 моль/л; [В] = 0,7 – 0,44 = = 0,26 моль/л; [С] = 0,44 · 2 = 0,88 моль/л.
Пример 5. Вычислите, во сколько раз возрастет скорость химической реакции при увеличении температуры на 40°С, если температурный коэффициент этой реакции равен 3.
Решение. Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа.
В данном примере температура повысилась на 40°С,
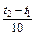 = 4.
= 4.
Следовательно, скорость реакции возросла в 34 = 81 раз.
Вопросы для самоподготовки
1. Сформулируйте закон действия масс, закон Вант-Гоффа, принцип Ле-Шателье.
2. Назовите факторы, влияющие на скорость реакции.
3. Что называется константой равновесия, от чего она зависит и что характеризует?
4. Реакция идет по уравнению 4HCI(г) + O2(г) = 2H2O(г) + 2CI2(г). Как изменится скорость реакции, если давление в системе увеличить в 3 раза?
5. Во сколько раз следует увеличить концентрацию водорода, чтобы скорость реакции N2(г) + 3H2(г)®2NH3(г) возросла в 1000 раз? Как нужно изменить давление, чтобы добиться такого же ускорения реакции?
6. В какую сторону смещается равновесие: а) при повышении температуры; б) при повышении давления:
2H2(г) + O2(г)⇆2H2O(пар) + 249,9 кДж
2SO2(г) + O2(г)⇆2SO3(г) + 198,4 кДж
7. Равновесие системы 2NO(г) + O2(г)®2NO2(г) установилось при следующих концентрациях веществ: [NO] = 0,08 моль/л; [O2] = 0,03 моль/л; [NO2] = 0,01 моль/л. Вычислите константу равновесия и исходные концентрации NO и O2, если исходная концентрация NO2 равна нулю.
ТЕСТЫ
1. Как изменится скорость прямой реакции А(г) + 2В(г)→АВ2, если давление в системе увеличить в 4 раза?
а) скорость уменьшится в 10 раз;
б) скорость не изменится;
в) скорость увеличится в 16 раз;
г) скорость увеличится в 64 раза.
2. Температурный коэффициент скорости некоторой реакции равен 2,0. Как изменится скорость этой реакции, если понизить на 40 градусов?
а) увеличится в 8 раз;
б) уменьшится в 8;
в) уменьшится в 16 раз;
г) увеличится в 16 раз.
3. В гомогенной системе А + В = 2С равновесные концентрации реагирующих газов (моль/л): [А] = 0,06; [В] = 0,2; [С] = 0,8. Вычислите константу равновесия системы.
а) 4,6;
б) 25;
в) 12;
г) 53.
4. Для реакции NO(г) + O2(г) = NO2(г) при 25°С Кр = 0,1. Какова ∆G реакции?
а) 23,5 кДж/моль;
б) -5,7Дж/моль;
в) -44,8 кДж/моль;
г) 22,44 кДж/моль.
5. В каком направлении сместится равновесие при понижении температуры в реакции:
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г )(∆Ho= -1323 кДж )?
а) сместится вправо;
б) сместится влево;
в) равновесие не изменится.
 2015-05-13
2015-05-13 14066
14066
