Термодинамические потенциалы. Введение в неравновесную термодинамику.
Основное неравенство и основное уравнение термодинамики
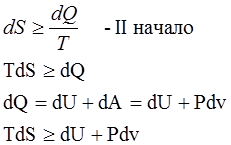
Основное неравенство термодинамики
= - соответствует равновесным термодинамическим процессам
> - неравновесным
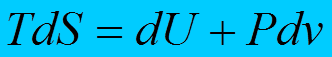
Основное уравнение термодинамики равновесных (обратимых) процессов
Термодинамические потенциалы
Это метод описания равновесных термодинамических процессов в 1873-1878 разработан Джорджом Гиббсом.
Суть:
Основное уравнение термодинамики равновесных процессов совместно с уравнением состояния системы и выражением для внутренней энергии образуют систему трех уравнений
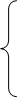
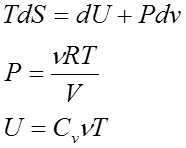
Которая является полноценной и совместной
В зависимости от выбора двух независимых параметров можно ввести термодинамические потенциалы, дифференцирование которых даст возможность вычислить другие параметры состояния равновесных процессов в термодинамической системе.
1. Внутренняя энергия U – термодинамический потенциал.
Пусть V и S – независимые параметры
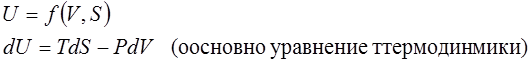
Полный дифференциал функции
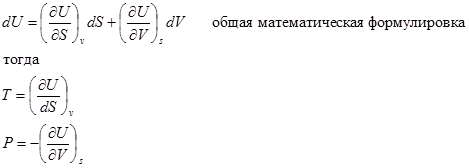
Т.е. мы получили формулы для нахождения остальных двух параметров из пяти (P,V,T,U,S)
2. Энтальпия H=U+PV – термодинамический потенциал
Пусть независимыми параметрами термодинамической системы будут P и S. Тогда основное уравнение
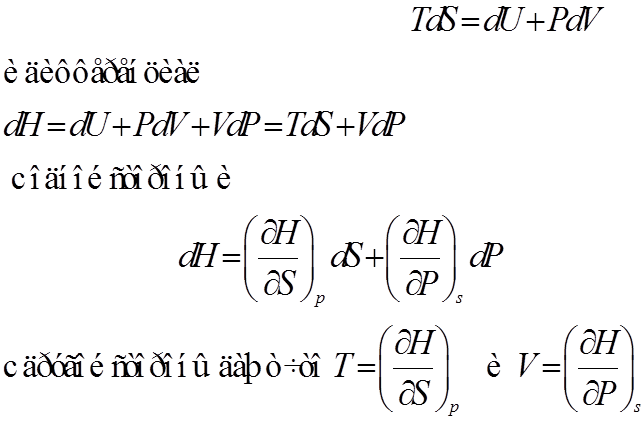
3. Свободная энергия. ш = U-TS – термодинамический потенциал Гельмгольца.
Пусть независимыми параметрами будут V и T.
ш = U-TS

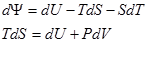
Тогда
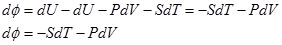
С другой стороны 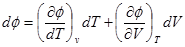
Отсюда 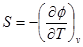
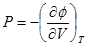
Для необратимого процесса
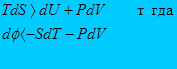
Отсюда следует что если в системе проходит необратимый процесс при котором
Т=const и V=const то dT=0, dV=0, dш<0, а если обратимый то dш>0.
Это означает что при необратимом процессе свободная энергия термодинамической системы уменьшается и достигает своего минимума в состоянии равновесия.
4. Энергия Гиббса.
5.
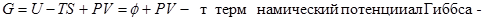
Независимые параметры P и T
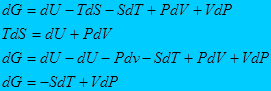
С другой стороны 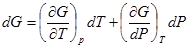
Тогда 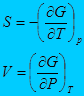
Взаимосвязь между термодинамическими потенциалами:
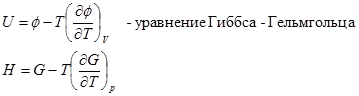
 2015-05-10
2015-05-10 1262
1262







