Удельной теплоемкостью называется количество теплоты Q, которое необходимо сообщить единице количества вещества, чтобы изменить его температуру на один градус. В зависимости от способа измерения количества вещества различают:
– удельную массовую теплоемкость, Дж/(кг∙К):
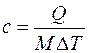 , (3.1)
, (3.1)
где М, кг – масса вещества;
– удельную объемную теплоемкость, Дж/(м3∙К):
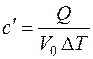 , (3.2)
, (3.2)
где V 0, м3 – объем вещества при нормальных физических условиях (см. разд.1);
– удельную мольную теплоемкость, Дж/(кмоль∙К):
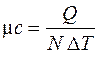 , (3.3)
, (3.3)
где N, кмоль – количество киломолей вещества.
Различные виды удельных теплоемкостей связаны между собой простыми соотношениями:
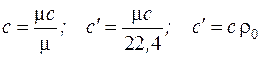 , (3.4)
, (3.4)
где 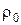 , кг/м3 – плотность газа при н.ф.у;
, кг/м3 – плотность газа при н.ф.у;
μ, кг/кмоль – молекулярная масса газа.
В зависимости от характера термодинамического процесса подвода тепла различают теплоемкости при постоянном объеме сv и при постоянном давлении сp, связанные между собой формулой Майера
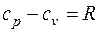 , (3.5)
, (3.5)
где R, Дж/(кг ∙К) – газовая постоянная.
По классической (молекулярно-кинетической) теории теплоемкость газов не зависит от температуры, а определяется только количеством атомов в молекуле (числом степеней свободы молекулы f): 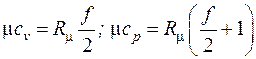 . Определенные таким образом мольные теплоемкости газов приводятся в табл. 3.1, массовые и объемные теплоемкости рассчитываются по выражениям (3.4). Полученные значения хорошо совпадают с экспериментальными данными в области комнатных температур.
. Определенные таким образом мольные теплоемкости газов приводятся в табл. 3.1, массовые и объемные теплоемкости рассчитываются по выражениям (3.4). Полученные значения хорошо совпадают с экспериментальными данными в области комнатных температур.
Отношение теплоемкостей
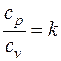 (3.6)
(3.6)
называется показателем адиабаты, который для идеального газа также зависит только от количества атомов в молекуле (табл. 3.1).
Таблица 3.1
Значения мольных теплоемкостей газов по классической теории
| Вид газа | Число степеней свободы | Показатель адиабаты | Мольные теплоемкости, кДж/(кмоль∙К) | |
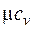
| 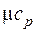
| |||
| 1-атомный | 1,67 | 12,47 | 20,79 | |
| 2-атомный | 1,40 | 20,79 | 29,10 | |
| 3-х и более атомный | 1,33 | 24,94 | 33,26 |
Эксперимент показывает, что теплоемкости газов заметно изменяются с температурой. Истинной теплоемкостью газа при данной температуре является величина 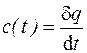 . Тогда средняя теплоемкость газа в интервале температур (
. Тогда средняя теплоемкость газа в интервале температур (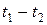 ) находится по формуле
) находится по формуле
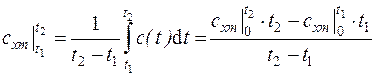 , (3.7)
, (3.7)
где 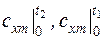 – средние теплоемкости в интервалах температур
– средние теплоемкости в интервалах температур 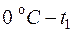 ,
, 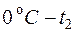 соответственно (берутся из таблиц – см. прил.1);
соответственно (берутся из таблиц – см. прил.1);
индекс x – обозначает характер процесса (p = const или v = const).
Средние массовая и объемная теплоемкости смеси газов находятся как
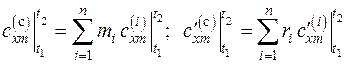 , (3.8)
, (3.8)
где 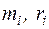 – соответственно массовые и объемные доли компонентов смеси.
– соответственно массовые и объемные доли компонентов смеси.
Внутренняя энергия термодинамической системы U, Дж – это энергия, связанная с различными формами движения и взаимодействия ее структурных частиц (кинетическая энергия движения молекул, потенциальная энергия взаимодействия молекул и др.). Удельная внутренняя энергия – это энергия, отнесенная к единице массы системы 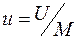 , Дж/кг.
, Дж/кг.
Внутренняя энергия является однозначной функцией состояния системы, т. е. зависит только от параметров термодинамической системы, например 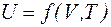 .
.
Для идеального газа внутренняя энергия зависит только от температуры и находится как:
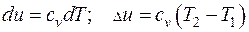 . (3.9)
. (3.9)
Энтальпия – это энергия расширенной термодинамической системы, включающей в себя саму систему и окружающую среду (оболочку, удерживающую систему в заданном объеме). Энтальпия H, Дж, и удельная энтальпия 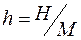 , Дж/кг, определяются как:
, Дж/кг, определяются как:
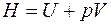 ; (3.10)
; (3.10)
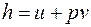 . (3.11)
. (3.11)
Энтальпия является однозначной функцией состояния системы, т. е. зависит только от параметров термодинамической системы, например 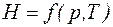 .
.
Энтальпия идеального газа зависит только от температуры:
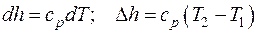 . (3.12)
. (3.12)
В формулах (3.9), (3.12) теплоемкости газа при постоянном давлении ср и при постоянном объеме сv определяются либо методами молекулярно-кинетической теории по табл. 3.1, либо как средние теплоемкости в интервале температур от Т 1 до Т 2 по уравнению (3.7).
Задачи
3.1. Найти среднюю удельную теплоемкость cp азота в интервале температур от 1000 оС до 2000 оС, если известно, что 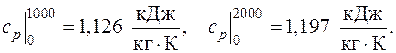
 2015-05-13
2015-05-13 1362
1362








