ü Не ударяйте и не роняйте сосуд Дьюара
ü Не позволяйте каким либо твердым предметам падать на поверхность или во внутрь сосуда
ü Не царапайте стеклянную поверхность острым предметом
Выполнение измерений
1. Не задевая водоотделитель, приподнимите сосуд Дьюара и выставите нулевой отсчет на весах.
2. Поставьте сосуд Дьюара на весы и определите массу пустого сосуда mK.
3. Налейте приблизительно 150 г дистиллированной воды в пластиковый стакан и нагрейте кипятильником воду массой m2 до температуры между 40°С и 50°С.
4. Налейте теплую воду из пластикового стакана в сосуд Дьюара. Определите массу воды m2 и её температуру 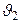 . Для определения температуры нажмите кнопку «меню» на панели сенсора.
. Для определения температуры нажмите кнопку «меню» на панели сенсора.
5. Взвести лёд массой m1 и положите его в теплую воду
6. Перемешивайте до тех пор, пока лёд не растает, и определите температуру 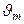
Обработка и представление результатов
7. Используя формулы (1-5), определите удельную теплоту плавления льда.
8. Эксперимент проведите три раза и определите среднюю удельную теплоту плавления льда.
232. Наблюдение фазового перехода жидкость-газ в критической точке

 Введение
Введение
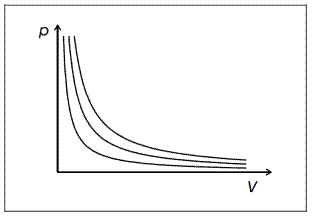
Одной из важных характеристик идеального газа является то, что он не конденсируется, даже если температура достигает абсолютного нуля. Такого газа в природе не существует. В противном случае он должен был бы состоять из частиц, которые малы по сравнению со средними расстояниям между ними даже при низких температурах. А так же, которые, за исключением упругих столкновений, не взаимодействуют друг с другом. Когда идеальный газ сжимают при постоянной температуре, давление увеличивается обратно пропорционально объему (см. рис. 1). Отношение между давлением p, температурой Т и молярным объемом V идеального газа описывается уравнением состояния идеального газа:
| pV=RT, | (1) |
где 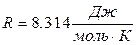 – газовая постоянная.
– газовая постоянная.

 Большинство реальных газов приближаются к свойствам идеального газа тогда, когда их состояние довольно далеко от точки конденсации или сжижения, т. е. при комнатной температуре и атмосферном давлении. Как только газ приближается к точке конденсации, т. е. при повышении давления p или при понижении температуры T, его свойства значительно отклоняются от свойств идеального газа. Плотность газа увеличивается, и частицы в среднем располагаются экстремально близко друг к другу. Поведение реального газа приблизительно описывается уравнением Ван дер Ваальса:
Большинство реальных газов приближаются к свойствам идеального газа тогда, когда их состояние довольно далеко от точки конденсации или сжижения, т. е. при комнатной температуре и атмосферном давлении. Как только газ приближается к точке конденсации, т. е. при повышении давления p или при понижении температуры T, его свойства значительно отклоняются от свойств идеального газа. Плотность газа увеличивается, и частицы в среднем располагаются экстремально близко друг к другу. Поведение реального газа приблизительно описывается уравнением Ван дер Ваальса:
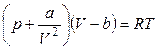
| (2) |
В этом уравнении, зависящие от вещества, константы a и b имеют смысл поправок на взаимное притяжение частиц газа и их эффективный объем.
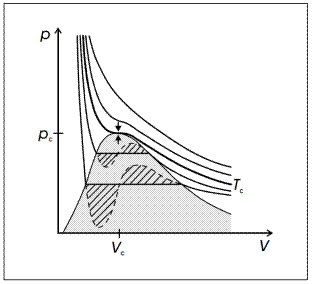
На Рис. 2 показаны изотермы реального газа в виде PV диаграммы. Изотерма, к которой может быть проведена горизонтальная касательная в переломной точке, имеет особое значение. Точку перегиба определяют как критическую точку, а величины, связанные с ней, называют: критическим давлением p с, критическим молярным объемом V с и критической температурой T с.
При температурах ваше критической вещество находится в газообразном состоянии при любых давлениях и изотермы соответствуют уравнению Ван-дер-Ваальса, которое в этом случае приближается к уравнению состояния идеального газа. Вещество называют газом.
При температурах ниже критической, ситуация намного сложнее. Если объем достаточно большой (рис.2 справа от затененной области), вещество находится в газообразном состоянии, и называется паром. В малых объемах (слева от затененной области), вещество является жидкостью и она практически несжимаема. Затененная область относится к смеси жидкость-пар в котором объем пара пропорционально увеличивается с лево на право. В этой области уравнение Ван-дер Ваальса отклоняется от действительности: при постоянной температуре, изменение объема приводит к изменению пропорции пара в смеси, но давление в смеси не изменяется. Пунктирные кривые, которые соответствуют уравнению Ван-дер Ваальса, должны быть заменены на горизонтальные отрезки. Отрезки соответствуют давлению пара, при котором пар и жидкость находятся в равновесии друг с другом. Жидкость и пар разделяются под действием силы тяжести, так как имеют различные плотности. Плотность пара увеличивается с температурой, в то время как плотность жидкости уменьшается. При критической температуре их плотности одинаковы. Жидкость и пар неразличимы, они полностью перемешаны.
Когда смесь находится в критическом состоянии (точке), рассеяние света в барокамере достигает очень высокого уровня. Этот феномен назван критической опалесценцией и происходит из-за флуктуаций плотности. Флуктуации значительно увеличиваются при приближении к критической точке, потому что сжимаемость сильно возрастает и сопротивление изменению плотности становится слабым. Коротковолновый свет рассеивается значительно сильнее чем длинноволновый.
Это явление можно наблюдать в барокамере при критической температуре. Оболочка камеры нагревается потоком горячей воды или паром. Два устойчивых к высокому давлению прозрачных окна позволяют нам наблюдать поведение субстанции внутри барокамеры, когда она достигает критической температуры T c при нагревании, и наоборот, когда остывает. Явление может наблюдаться непосредственно в барокамере, либо проецировать на экран.
Барокамера заполнена фторидом серы SF6. При комнатной температуре, величина критической плотности SF6 (обратное от критического объема) приблизительно равна усредненному значению плотности жидкости и газа. При комнатной температуре барокамера наполовину наполнена сжиженным газом и таким образом при нагревании система способна пройти через критическую точку.
SF6 имеет следующие значения термодинамических величин в критической точке: критическая температура: T c=318.7 K, критическое давление: p c=37.6 Атм и критический молярный объем: V c=200 см3/моль
Цель работы
- Наблюдение размытия границы раздела фаз между жидкостью и газом при нагревании выше критической температуры.
- Наблюдение образования границы раздела фаз при охлаждении ниже критической температуры.
- Наблюдение критической опалесценции.
Решаемые задачи
ü измерение температуры с помощью термопары
ü использование оптических приборов для создания изображения физического процесса в проходящем свете
ü наблюдение фазового перехода первого рода в барокамере
Экспериментальная установка
Приборы и принадлежности
ü барокамера
ü лампа с фокусирующим объективом
ü трансформатор
ü оптическая скамья
ü линза в держателе
ü прямоугольная призма
ü четыре струбцины
ü лабораторный штатив
ü термостат замкнутого цикла
ü резиновые трубки
ü цифровой термометр
ü температурный датчик (термопара NiCr-Ni)
Порядок выполнения работы
Требования безопасности при работе с барокамерой
ü Для нагрева барокамеры использовать только пар или циркулирующую воду.
ü Во избежание обжога не касаться барокамеры во время эксперимента.
ü Необходимо осторожно проверить выход горячей воды или пара.
ü Перед началом эксперимента проверить надёжность закрепления трубок.
ü Не ослаблять винт-заглушку при повышенном давлении в барокамере.
ü Не нагревайть барокамеру выше 90º.
 |
Подготовка установки к работе
1. Проверьте по рис.1а комплектность и правильность сборки экспериментальной установки.
2. Для улучшения теплового контакта добавьте немного воды в отверстие с температурным датчиком.
3. Включите лампу и спроецируйте изображение вещества, заполняющего барокамеру, на экран (например, лист белой бумаги).
4. Сфокусируйте изображение мениска жидкости, передвигая линзу вдоль оптической скамьи.
Выполнение измерений
5. Включите термостат и установите начальную температуру 40°С.
6. После достижения температуры 40°С, повышайте температуру циркулирующей воды медленно, чтобы нагрев содержимого барокамеры происходил равномерно. Это позволит отчетливо наблюдать размытие границы раздела фаз.
7. После того, как температура превысит критическое значение, установите температуру на термостате ниже критической температуры.
8. Чтобы уменьшить отрицательное воздействие температурных градиентов по объему камеры, целесообразно после того, как температура в системе спадёт ниже критической, вновь постепенно увеличить температуру и повторить эксперимент.
9. Как результат вашего наблюдения запишите значение критической температуры.
 |
Пример наблюдения
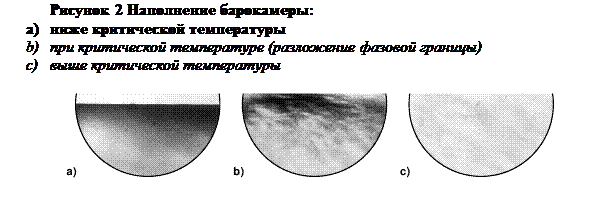
Сразу после начала нагрева, в жидкой фазе появляются прослойки (неоднородности в форме полос). Далее жидкость начинает кипеть, а с верхней части камеры, капать конденсат. Окончательно, появляются прослойки в газовой фазе, особенно на границе. Незадолго до достижения критической точки, кипение становится таким интенсивным, что жидкость, неоднородная вследствие пузырьков газа, рассеивает свет по всем направлениям (диффузно). Это затемняет проецируемое изображение жидкости. Неоднородности становятся более интенсивными, изначально в газовой фазе непосредственно выше границы раздела, затем внутри газовой фазы и, окончательно, в оставшейся жидкой фазе.
Когда система медленно проходит через критическую температуру, фазовая граница между жидкостью и газом начинает флуктуировать, расширяться и, в итоге, исчезает. В последний момент, перед исчезновением границы, жидкая фаза принимает коричневый оттенок. Исчезновение границы между газовой и жидкой фазой можно наблюдать на проецируемом изображении. Изображение становится ярким, как только содержание барокамеры трансформируется в однородную фазу. Тем не менее, в барокамере наблюдается интенсивная турбулентность с прослойками, которая рассеивается при дальнейшем повышении температуры. Эти процессы обусловлены имеющимися в камере градиентами температуры.
После выключения нагрева, прослойки, почти полностью исчезнувшие, становятся опять отчетливыми при приближении к критической температуре. В нижней части камеры наблюдается небольшое затемнение обусловленное образованием аэрозоли. Содержимое барокамеры, целиком, становится все более и более красно-коричневым (критическая опалесценция). Прослойки продолжают увеличиваться. Внезапно, внутри барокамеры темнеет, газ конденсируется и наблюдается рост уровня жидкости. Газовая фаза содержит аэрозоль, которая постепенно конденсируется. Окончательно, газовая фаза становится прозрачной, в то время как жидкая фаза продолжает кипеть.
При возобновлении нагрева, жидкость кипит все более и более интенсивно. Далее, газовая фаза становится желтоватой, а жидкая приобретает красно-коричневый цвет (критическая опалесценция). Граница раздела расширяется, затем полностью исчезает. Сразу выше критической температуры, содержимое барокамеры становится однородно желто-коричневым, вместе с интенсивными прослойками и бурной турбулентностью. В итоге, температура выходит из диапазона существования критической опалесценции и в барокамере наблюдаются только вихревые прослойки.
234. ИССЛЕДОВАНИЕ ЭФФЕКТА ДЖОУЛЯ-ТОМСОНА ДЛЯ РАЗЛИЧНЫХ ГАЗОВ
Введение
Уравнения состояния реальных газов должно учитывать конечное значение собственного объема молекул и взаимное притяжение их друг к другу. Ван-дер-Ваальс предложил в уравнения состояния для одного моля реального газа включить не объем сосуда, а объем не занятый молекулами, т.е. величину (Vm-b), где Vm – молярный объем. Постоянная b определяет ту часть объема, которая недоступна для движения молекул вследствие их конечного размера. Для нахождения величины b предположим, что в сосуде имеются лишь две молекулы, центры которых не могут сблизиться на расстояние, меньше s. Таким образом, для центра каждой молекулы недоступным оказывается объем шара радиусом s, равный 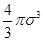 , а в расчете на одну молекулу – объем, вдвое меньший. Исходя из этого примерного расчета, недоступный объем для NA молекул
, а в расчете на одну молекулу – объем, вдвое меньший. Исходя из этого примерного расчета, недоступный объем для NA молекул
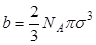 . .
| (1) |
Окружим каждую молекулы сферой молекулярного действия. Если эта сфера находится внутри газа, то силы, действующие на рассматриваемую молекулу со стороны окружающих молекул, в среднем уравновешиваются. Но этого не произойдет, если молекула находится вблизи газа со стенкой. Появляется избыток молекул, тянущих рассматриваемую молекулу внутрь газа, над молекулами, тянущими ее наружу. Таким образом, вблизи стенки возникает пристеночный слой газа, толщина которого равна радиусу сферы молекулярного действия. Вследствие притяжения ударяющих о стенку молекул всеми остальными молекулами газа давление, оказываемое газом на стенку, уменьшается на величину pi. pi называется внутренним или молекулярным давлением. Поскольку силы взаимодействия молекул очень быстро убывают с расстоянием, то следует учитывать притяжение одного лишь соседнего слоя. Сила этого притяжения (рассчитанная на единицу площади) пропорциональна концентрации молекул в обоих слоях или обратно пропорциональны объему газа 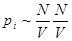 . Введя коэффициенты пропорциональности можно перейти к равенству для одного моля газа:
. Введя коэффициенты пропорциональности можно перейти к равенству для одного моля газа:
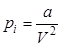 , ,
| (2) |
где а – постоянная, характерная для рассматриваемого газа. Тогда уравнение состояния для моля газа Ван-дер-Ваальса будет иметь вид:
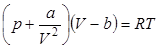 . .
| (3) |
Внутренняя энергия газа Ван-дер-Ваальса состоит из двух частей: кинетической энергии поступательного и вращательного движения молекул ЕК и потенциальной энергии их взаимодействия ЕП. Предполагая, что к реальному газу по-прежнему применима теорема о равномерном распределении энергии по степеням свободы, можно для расчета ЕК воспользоваться формулой, полученной для одного моля идеального газа:
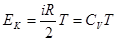 . .
| (4) |
Потенциальная энергия взаимодействия молекул определяется следующим образом. При расширении газа силы внутреннего или молекулярного давления 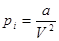 совершает работу, которая равна
совершает работу, которая равна
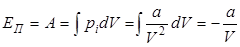 . .
| (5) |
Окончательно, внутренняя энергия одного моля реального газа равна:
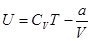 . .
| (6) |
Прохождение газа через пористую перегородку (адиабатическое дросселирование) в теплоизолированной трубе сопровождается расширением и изменением температуры газа (эффект Джоуля-Томсона). Если до расширения газ считать ван-дер-ваальсовским, а после расширения – идеальным, то температура газа или уменьшается или возрастает. Рассмотрим прохождение одного моля газа через перегородку. Процесс будем считать адиабатическим. (Это интегральный эффект Джоуля-Томсона).
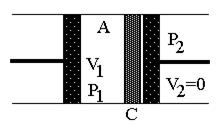
| 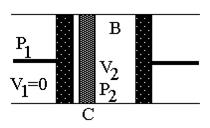
|
| Рис.1а | Рис.1б |
На рисунке изображена схема расширения газа в адиабатических условиях. На рис.1а – начальное состояние системы, на рис.1б – конечное. В середине цилиндра, помещенного в адиабатическую оболочку, находится перегородка С (узкая щель, пористое тело, дроссель и т.п.), препятствующая быстрому прохождению газа. Из части 1 поршнем через перегородку продавливается газ, в результате чего объем газа меняется от V1 до нуля. При этом в части 2 перемещается поршень, и объем газа при постоянном давлении изменяется от нуля до V2. Так как величины давления p1 и p2 постоянны, то в части 1 газ совершает работу А1=-p1V1, а в части 2 A2=p2V2. Будем считать, что внутренняя энергия системы изменилась на величину U2-U1.
Запишем для этого процесса первое начало термодинамики
Q=U2-U1+p2V2-p1V1.
Так как процесс адиабатический (Q=0), то имеем
U1+p1V1=U2+p2V2.
Для одного моля реального газа
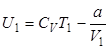 ;
; 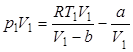 .
.
Для одного моля идеального газа
U2=CVT2; p2V2=RT2.
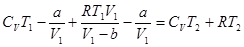 .
.
Преобразуем выражение следующим образом:
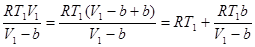 ,
,
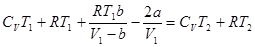 .
.
Отсюда следует, что:
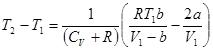 или
или
.
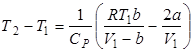 . .
| (7) |
.
Из этого условия ясно, что расширение реального газа без теплообмена должно сопровождаться изменением его температуры. Температура реальных газов в таком процессе может, как понижаться: DT<0 (положительный эффект Джоуля-Томсона), так и повышаться: DT>0 (отрицательный эффект Джоуля-Томсона). Температура, при которой происходит изменение знака эффекта Джоуля-Томсона, называется температурой инверсии:
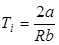 . .
| (8) |
Газ, имеющий температуру выше температуры инверсии, нагревается, ниже – охлаждается. Температура инверсии зависит от давления и свойств газа, поэтому при одной и той же температуре некоторые газы могут нагреваться, а другие охлаждаться. Например, при комнатной температуре и невысоком давлении воздух при адиабатическом дросселировании в процессе Джоуля-Томсона охлаждается, тогда, как для достижения такого же эффекта водород следует охладить до 200К, а гелий до 40К.
Цель работы
Наблюдение эффекта Джоуля – Томпсона для различных газов
Решаемые задачи
1. Измерение временной зависимости разности температур между двумя камерами при различных давлениях.
2. Определения времени релаксации.
Экспериментальная установка
Приборы и принадлежности
3. Баллоны со сжатым газом
4. V-образное основание штатива, 28 см.
5. Штативный стержень, 47 см
6. Универсальный зажим I
7. Воздушный дроссель для наблюдения эффекта Джоуля –Томсона
8. Сенсор - CASSY 2
9. Устройство измерения температуры (NiCr-Ni, NTС)
10. Датчик давления S, ±2000 гПа
11. Стальной газовый баллон с углекислотой
12. Стальной газовый баллон с азотом
13. Газовый редуктор
14. Газовый редуктор (азот)
15. Стальной ключ 30/32 мм, для газовых баллонов
16. Термопара NiCr-Ni
17. Универсальный зажим, 0-80 мм
18. Хомуты для трубок 10-16 мм (10 шт.)
19. Вакуумная резиновая подводка, Ø 8 мм
20. Специализированный ноутбук для использования в лабораторных установках LD
 Газ в камере 1 имеет постоянное давление P1. Газ будет проходить через мембрану (медленный процесс без турбулентности) в камеру 2 с постоянным давлением P2 (P2<P1). С помощью двух термопар можно измерить разность температур в камерах 1 и 2.
Газ в камере 1 имеет постоянное давление P1. Газ будет проходить через мембрану (медленный процесс без турбулентности) в камеру 2 с постоянным давлением P2 (P2<P1). С помощью двух термопар можно измерить разность температур в камерах 1 и 2.
Порядок выполнения работы
Требования безопасности при использовании газовых баллонов
 2015-05-13
2015-05-13 656
656








