Строение металлов и сплавов изучают при помощи рентгеноструктурного анализа и электронных микроскопов, позволяющих увеличивать изображение в 20...30 тыс. раз.
Установлено, что атомы металлов в зернах занимают строго определенные места, образуя элементарные ячейки так называемой пространственной (объемной) кристаллической решетки. В «узлах» металлической решетки находятся не атомы в чистом виде, а положительные ионы металлов, окруженные электронами. Эти обобщенные электроны более или менее свободно перемещаются между ионами, не теряя в то же время связи с ними, поэтому выйти за пределы решетки при обычных условиях они не могут. Их называют полусвободными электронами или «электронным газом». Отсюда и типичные для металлов свойства: электро- и теплопроводность, способность отражать световые лучи (блеск металлов) и радиоволны (на чем основана радиолокация), серовато-серебристый (у некоторых золотистый) цвет, пластичность, ковкость, механическая прочность.
Пары металла состоят из одноатомных молекул, связанных друг с другом только слабыми силами межмолекулярного взаимодействия, поэтому пары металлов не обладают электропроводностью, невелика их теплопроводность.
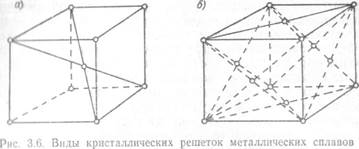 а - центрированный куб; б - куб а - центрированный куб; б - куб |
Элементарные ячейки бывают различного типа, что определяется химической природой или состоянием данного металла. Атомы таких металлов, как железо (при температуре ниже 910°С), хром, молибден, вольфрам расположены по углам кубика элементарной ячейки и один атом находится в центре этой ячейки; общее число атомов, образующих ячейку, равно 9. Такая ячейка (центрированный куб) является элементарным кристаллом, из очень большого числа которых и состоят нее кристаллические зерна этих металлов (рис. 3.6, а). Если железо нагреть до температуры выше 910 °С, в элементарных ячейках железа произойдет перестановка (перестройка) атомов: атомы расположатся по углам куба и в центре каждой его грани (куб с центрированными гранями). Число атомов в каждой элементарной ячейке железа при нагревании его выше 910 °С увеличивается с 9 до 14, и объем куба, образуемого атомами, значительно возрастает (рис. 3.6,б).
Аналогичное расположение атомов наблюдается в кристаллических зернах ряда металлов: алюминия, меди, никеля. У цинка, магния и титана атомы внутри зерен образуют элементарные ячейки в форме шестигранной призмы. В этих кристаллах 12 атомов расположены по углам двух шестиугольных оснований призмы, два атома - в центре этих оснований, три атома - внутри призмы.
Такое расположение атомов в элементарных ячейках цинка, магния и других металлов образует так называемую гексагональную (шестигранную) элементарную ячейку пространственной решетки.
При переходе металла из жидкого состояния в твердое первоначально образуются мелкие кристаллики-центры кристаллизации. Пока они растут свободно, их Геометрическая форма является правильной, строго кристаллической. Однако как только растущие кристаллы начнут соприкасаться друг с другом, правильность их формы нарушается. Кристаллы начинают теснить друг друга. В затвердевшем металле они соприкасаются.
Сплавы металлов также имеют кристаллическое строение, однако их структура сложнее структуры однородного металла, так как сплав состоит из нескольких металлов — компонентов (составляющих).
Когда сплав находится в жидком состоянии, то при любых пропорциях входящих в него металлов он представляет собой однородную смесь. При кристаллизации компоненты сплава могут образовать твердые растворы, химические соединения, механические смеси.
Твердыми растворами называются однородные твердые смеси. Один металл может растворяться в другом или в любой пропорции до известного предела, называемого насыщенным. Атомы сплавов образуют общую кристаллическую решетку.
При образовании кристаллов твердого раствора атомы растворяемого металла или внедряются в решетку между атомами растворителя, или замещают их в узлах кристаллических решеток. Иногда при образовании твердого раствора происходит одновременно и замещение и внедрение атомов растворителей.
Химические соединения образуются при строго определенной концентрации компонентов, формирующих новый тип кристаллической решетки. Свойства химического соединения резко отличаются от свойств компонентов. Примером химического соединения является карбид железа Fe3C.
Если компоненты в твердом состоянии не образуют ни твердый раствор, ни химическое соединение, то они будут находиться в состоянии механической смеси. При этом в сплаве будут кристаллические решетки обоих сплавов. Механическую смесь, например, образуют свинец и сурьма.
Основные понятия о диаграмме состояния железоуглеродистых сплавов. Основными составляющими компонентами сталей и чугунов являются железо и углерод.
Железо - серебристо-белый металл с температурой плавления 1539 °С. Железо имеет различную кристаллическую
 |
 |
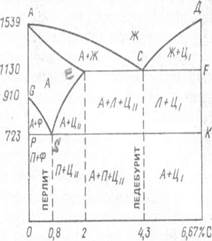
| Рис 3.7. График охлаждения железа |
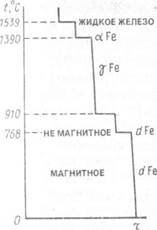
Рис. 3.8. Диаграмма состояния железоуглеродистых сталей
структуру: при температуре от 1539 до 1390 и ниже 910°С- кубическую объемно-центрированную решетку и обозначается aFe; при температуре 1390 °С- кубическую гранецентрированную решетку.
Температуры, при которых сплав переходит из одного состояния в другое, называют кристаллическими точками: например aFe переходит в yFe при 910 °С (910 °С - кристаллическая точка).
Диаграмма состояния показывает состояние сплава при любой температуре и любой концентрации.
Диаграммы состояния строят на основании кривых охлаждения. Для получения графика охлаждения расплавляют металл до жидкого состояния и в него помешают термопару для замера температуры. Затем металлу дают возможность медленно охлаждаться. При охлаждении замеряют температуру металла через определенные промежутки времени. На основании полученных данных строят кривую охлаждения.
График охлаждения чистого железа, приведенный на рис. 3.7, читается следующим образом. При застывании жидкого железа до 1539 °С линия охлаждения изменяется плавно. При температуре 1539°С на кривой образуется горизонтальный участок, показывающий температуру затвердевания металла, при которой происходит процесс кристаллизации металла, сопровождающийся выделением теплоты. Участок от 1539 до 1390 °С указывает на охлаждение. При температуре 1390 °С на кривой снова появляется горизонтальная площадка, так как в течение перестройки кристаллической решетки aFe в yFe выделяется теплота. Перестройка кристаллической решетки vFe в немагнитное, а затем магнитное железо также происходит с выделением теплоты (показано на графике горизонтальными участками при t = 910°С и t = 768°С).
Кривые охлаждения выводят для сплавов разной концентрации, а затем по этим кривым строят диаграмму состояния в координатах «температура — концентрация». Диаграмму состояний различных систем составляют для равновесных структур, поэтому на диаграмме (рис. 3.8) Fe— Fe2 С все линии и точки даны для сплавов, находящихся в равновесном состоянии. Структура сплава называется равновесной, если скорость охлаждения настолько мала, что все процессы, которые должны совершаться в сплаве при охлаждении, закончились.
Прежде чем изучить диаграмму Fe—Fe3C, рассмотрим, какие структуры образуют железо с углеродом. К основным структурам относятся следующие.
1. Жидкий раствор углерода в расплавленном железе.
2. Феррит- твердый раствор углерода в aFe, технически чистое железо. В aFe может растворяться до 0,02 % углерода.
3. Аустенит- твердый раствор углерода в yFe (при t= 1130°С может растворяться до 2 % углерода). Аустенит обладает высокой пластичностью и вязкостью.
4. Цементит- химическое соединение железа с углеродом. Имеет высокую твердость и низкую вязкость.
5. Перлит- механическая смесь, состоящая из феррита и вторичного цементита.
Превращение из жидкого состояния в твердое (первичная кристаллизация) происходит по линии ACD (см. рис. 3.8), которая называется ликвидусом (по-латински «жидкий»). Выше линии ACD сплавы системы находятся в жидком состоянии (Ж). Линия АС указывает на то, что из жидкого раствора начинают выпадать кристаллы твердого раствора углерода в у-железе т.е. аустенита (А). Таким образом, ниже линии АС находится смесь двух фаз — жидкого раствора и аустенита (Ж+А). Окончательное затвердевание стали выражено линией АЕС. Отсюда видно, что в отличие от чистого железа кристаллизация стали происходит не в одной точке, и н интервале температур. Например, для стали с содержанием 1,2% углерода разница между началом и концом затвердевания составляет около 250 °С. Это имеет большое практическое значение, так как в процессе затвердевания стали сначала из жидкости выпадают кристаллы из наиболее чистого тугоплавкого сплава, а в конце затвердевания идет кристаллизация более легкоплавкого, загрязненного примесями сплава, т.е. затвердевшая сталь получает неоднородное кристаллическое строение.
По линии CD из жидкого раствора выпадают кристаллы цементита (Ц), поэтому в области CFD находится смесь двух фаз - жидкого раствора и цементита (Ж+Ц1). В точке С при содержании 4,3% и температуре 1130 °С происходит одновременно кристаллизация аустенита и цементита и образуется тонкая механическая смесь — эвтектика, которая называется ледебуритом.
Превращения в твердом состоянии (вторичная кристаллизация) выражены линией AECF, которую называют солидусом (по-латински «твердый»). Превращения н твердом веществе происходят вследствие перехода железа из одной модификации в другую при изменении степени растворимости углерода в железе.
На рис. 3.8 область, ограниченная линиями GSEA, является областью аустенита. При охлаждении сплавов аустенит распадается, выделяя феррит (Ф) (линия GS) п цементит (Цп) (линия SE), который выпадает из твердого раствора и называется избыточным, или вторичным в отличие от первичного цемента, выпадающего из жидкого раствора. В области диаграммы GS находится смесь феррита и аустенита (Ф+А), а в области SE — смесь вторичного цементита и аустенита. Область, ограниченная линией GS, имеет большое практическое значение, так как характеризует температуру нагрева при различных видах термической обработки стали с содержанием углерода ниже 0,8 %. При охлаждении стали с содержанием от 0 до 0,8 % по линии GS из аустенита начинает выделяться феррит. По мере понижения температуры с 910 до 723СС количество феррита непрерывно увеличивается, а количество аустенита уменьшается. Поскольку общее (среднее) содержание углерода и сплаве остается постоянным, то чем больше из твердого раствора выделится феррита, тем выше становится концентрация углерода в оставшемся аустените. При температуре 723 °С содержание углерода в феррите достигает 0,8 % и в точке 5 аустенит превращается в перлит, т. е. тонкую механическую смесь феррита и цементита.
Линия PSK показывает распад аустенита, оставшегося в любом сплаве системы, с образованием перлита. Линию PSK называют линией перлитового превращения
Термическая обработка металлов - это процессы нагревания и охлаждения для изменения физических, механических и технологических свойств сплава. Термическая обработка заключается в изменении структуры сплавов путем нагревания их до температуры выше критической и последующего охлаждения с той или иной скоростью.
Основой термической обработки являются процессы вторичной кристаллизации в стали, происходящие при "различных температурных режимах. Термической (тепловой) обработкой стали достигается весьма значительное изменение ее свойств при неизменном химическом составе, поэтому термическая обработка является распространенным и важным видом обработки металлов.
В зависимости от температуры и режима охлаждения термическая обработка подразделяется на отдельные самостоятельные операции: отжиг, нормализацию, закалку и отпуск. Режим термической обработки показан на рис. 3.9.
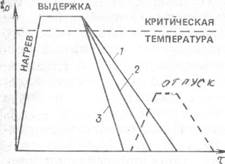 |
Рис.3.9 График режимов термической обработки
1-охлаждение с печью (отжиг); 2- охлаждение на воздухе (нормализация);
3- охлаждение в воде или масле (закалка);
При термической обработке изделия нагревают в пламенных печах, электропечах, а также печах-ваннах.
Отжигом называют нагревание и медленное охлаждение стали. Отжиг применяют для измельчения зерна, улучшения механических свойств стали, а также для уменьшения в ней внутренних напряжений.
Полным отжигом называют нагрев стали до температуры, превышающей критическую на 20...30°, и последующее медленное ее охлаждение (вместе с охлаждающей нагревательной печью). При нагреве а-железо переходит в у-железо. При этом цементит, содержащийся в стали, разлагается и переходит в аустенит (твердый раствор углерода в у-железе). Последующее медленное охлаждение закрепляет мелкозернистую мягкую структуру. После отжига сталь имеет перлитную структуру.
Диффузионный отжиг применяют для выравнивания химического состава стального изделия. Рекристаллизационный отжиг происходит при 500... 550 °С. Возврат (отдых) стали (нагрев до 200... 400 °С) применяют для уменьшения или снятия наклепа. Например, возврат производят для проволоки, применяемой при навязке соединительных головок на пожарные рукава.
Нормализация термическая обработка, подобная отжигу, но с более быстрым охлаждением изделий, которое выполняют на воздухе или в нагретом масле. Нагрев металла осуществляют до полной рекристаллизации. Вследствие нормализации сталь приобретает мелкозернистую структуру, повышенную прочность и более высокую твердость, чем при отжиге.
Закалкой называют нагрев стали до температуры, превышающей критическую на 30...50°С выдержку при этой температуре и последующее быстрое охлаждение в воде, растворах солей или масле. После закалки повышается прочность конструкционных сталей, увеличивается твердость и режущая способность инструментальных сталей.
При нагреве стали получается твердый раствор углерода в у-железе, а при последующем быстром охлаждении сохраняется твердый раствор углерода, только не у-, а в а-железе, при этом раствор становится перенасыщенным. Эта структура, называемая мартенситом, придает стали твердость, прочность, хрупкость, сопротивление истиранию. Чем выше скорость охлаждения, тем более хрупким и твердым становится металл.
При медленном охлаждении эвтектоидной стали происходит полный распад аустенита с образованием перлита. Распад состоит из следующих этапов:
1) превращение у-железа в а-железо, т.е. перегруппировка атомов из решетки гранецентрированного куба у-железа в решетку центрированного куба а-железа с одновременным смещением атомов углерода, находящегося в твердом растворе у-железа;
2) выделение из твердого раствора (аустенита) мельчайших частиц цементита (Fe зС);
3) укрупнение частиц цементита в пластинки, размеры которых измеряют от малых долей микрона до нескольких миллиметров.
При ускорении охлаждения до 50°С/с распад аустенита не успевает закончиться, размеры пластинок цементита достигают лишь десятых долей микрона - это структура сорбита.
При ускорении охлаждения до 100°С/с полностью успевает завершиться лишь второй этап распада аустенита, третий этап останавливается в самом начале охлаждения.
измеряют стотысячными и миллионными долями миллиметра. Такая структура носит название троостита.
Сорбит и троостит представляют собой, как и перлит, механическую смесь феррита и цементита. Отличие заключается в толщине пластинок феррита и цементита: в троостите они тоньше, а в сорбите толще.
При скорости охлаждения 200 С успевает завершиться лишь перегруппировка атомов железа, поэтому углерод остается в а-железе в виде твердого раствора. Эта структура называется мартенситом.
Мартенсит- самая твердая и самая хрупкая структура. Пластические свойства при растяжении и ударная вязкость близки к нулю. Плотность мартенсита меньше, чем плотность других структур, и составляет 7,75 г/см3. В связи с увеличением объема стали при мартенситном превращении возникают напряжения, особенно при неравномерном охлаждении детали. Мартенсит обладает магнитными свойствами и способностью сохранять остаточный магнетизм. Заготовки магнитов закаливают на мартенсит. Троостит и сорбит являются промежуточными структурами между перлитом и мартенситом.
Необходимо отметить, что низкоуглеродистые стали с содержанием углерода менее 0,4 % закалке не подвергают. Легированную сталь закаливают для повышения ее магнитных свойств и сопротивления коррозии.
Закаленная сталь отличается напряженным состоянием, которое является следствием быстрого охлаждения наружного слоя изделия и преобразования структуры. Детали, выполненные из закаленной стали, отличаются повышенной хрупкостью и на них образуются трещины, поэтому закалка должна сопровождаться отпуском.
Отпуском называют нагрев закаленной стали до температуры 723 °С, выдержку при этой температуре и последующее охлаждение на воздухе, в масле или воде. Практика показывает, что с повышением температуры отпуска все больше снижается твердость закаленной стали, поэтому для сохранения высокой твердости инструментальные стали подвергают низкому отпуску при температуре нагрева 180...220°С.
Закаленные конструкционные стали, работающие в условиях повышенных нагрузок, подвергают среднему отпуску при температуре нагрева 300...400°С. Для закаленных конструкционных сталей, которые работают при больших напряжениях и ударных нагрузках, применяют высокий отпуск при температуре нагрева 500...600°С.
Термическую обработку металлов широко используют при изготовлении и ремонте пожарно-технического вооружения. Так, при навязке пожарных рукавов на соединительные головки стальную проволоку для размягчения и повышения вязкости подвергают отжигу; рабочие части пожарного инструмента (ломы, багры, крюки)- закалке с последующим средним отпуском при температуре 275...285 °С.
Сталь марок 30Г, 30Г2, 40Г и 40Г2 для улучшения ее качества закаливают охлаждением в воде или в масле (в зависимости от формы и размеров изделий) на 30...40°С выше критической температуры и отпускают при 450...650°С (в зависимости от заданной твердости). Эту сталь применяют для изготовления коленчатых валов, полуосей и рычагов.
Сталь 50Г и 50Г2 охлаждают в масле при аналогичном режиме. Используют ее при изготовлении осей, коленчатых валов, червяков, шатунов, рессор.
На сталелитейных заводах выпускают шарикоподшипниковую сталь ШХ 6, ШХ 9, ШХ 12, ШХ 15. Для улучшения обрабатываемости и подготовки структуры к дальнейшей обработке шарикоподшипниковую сталь отжигают на зернистый перлит в течение 10...15 ч при температуре 780...800°С и медленно охлаждают. Закаливают при температуре 800...850°С с охлаждением в воде или в масле и отпускают при 180...200 °С.
Поверхностная закалка. В отличие от обычных методов закалки, когда структура изменяется на значительной глубине, применяют также закалку с изменением твердости только в поверхностном слое изделия. При этом сердцевина изделия остается нетронутой и, следовательно, более вязкой, чем наружный закаленный слой.
Такая неоднородная структура стали необходима для деталей, работающих на износ в условиях ударных нагрузок (зубчатые колеса редукторов пожарных автомобилей и механизированного инструмента, коленчатые валы двигателей внутреннего сгорания, валы насосов).
При поверхностной закалке наружные слои изделия подвергаются местному кратковременному нагреву и последующему быстрому охлаждению в воде или другой охлаждающей среде. Нагрев осуществляют пламенем кислородно-ацетиленовой горелки или токами высокой частоты.
Обработка холодом - это процесс охлаждения подвергнутых закалке и отпуску изделий до температур, лежащих ниже нуля (от —40 до —120 °С). Отрицательные охлаждающие температуры создают жидким кислородом, жидким воздухом, смесью сухого льда (твердый СО2) с ацетоном или спиртом.
В результате обработки холодом повышаются твердость, прочность и износостойкость деталей. Этому виду обработки подвергают режущий и измерительный инструмент. шариковые подшипники.
Химико-термической обработкой стали называется термическая обработка, связанная с изменением химического состава поверхности стальных изделий. Ниже рассмотрены отдельные виды химико-термической обработки.
Цементация - процесс насыщения стального изделия углеродом для получения высокой поверхностной твердости. При этом внутренняя часть изделия сохраняет вязкость. В результате цементации изделие становится вязким и твердым. Цементации подлежат изделия из мягких сталей, содержащих не более 0,1...0,25 % углерода после их окончательной механической обработки и имеющих небольшой припуск на шлифование. Толщина науглероженного слоя при цементации достигает 0,5...2 мм в зависимости от условий работы детали. В процессе науглероживания содержание углерода в поверхностном цементированном слое изделия повышается до 1... 1,2 %.
Для цементации применяют специальные вещества- карбюризаторы, содержащие и легко отдающие углерод. Карбюризаторы бывают твердые (древесный уголь, сода, углекислый барий), жидкие (расплавленные соли, богатые углеродом) и газообразные (естественный и светильный газы, продукты разложения нефти, метан).
Цементацию твердым карбюризатором осуществляют и металлических ящиках. При наличии на детали мест, не подлежащих цементации, их покрывают защитными обмазками (глина, асбест) или омедняют в гальванических ваннах. Перед установкой в печь цементационные ящики закрывают крышкой и замазывают огнеупорной глиной.
Под действием высокой температуры печи (900...950°С) карбюризатор разлагается, выделяя атомы углерода, который путем диффузии проникает в поверхность изделия. Углерод взаимодействует с кислородом воздуха: 2С + 02 = 2С0.
Оксид углерода при контакте с железом является неустойчивым и разлагается на диоксид углерода и атомарный углерод: 2СО = СОа + С.
Атомарный углерод в момент своего зарождения обладает большой химической активностью и диффундирует в железо. В цементационном ящике, наполненном угольной смесью, объем газовой среды постепенно уменьшается и переход углерода от карбюризатора в сталь постепенно замедляется. Для повышения активности процесса к мелкораздробленному углю добавляют активизаторы - углекислый барий или соду. Длительность цементации зависит от требуемой глубины цементированного слоя и продолжается 5...20 ч при средней скорости науглероживания 0,1 мм/ч. Контроль за протеканием процесса осуществляют на образцах - стальных прутках, химический состав которых не отличается от состава цементируемой стали. После цементации изделие приобретает крупнозернистое строение и поэтому подвергается нормализации, закалке и отпуску. В результате такой термической обработки получается мелкозернистая, мягкая и вязкая структура в средних частях изделия и твердая на его поверхности.
Газовую цементацию наиболее часто применяют в промышленности. Преимуществами газовой цементации являются: сокращение в 2...3 раза длительности процесса, удобство и легкость регулирования количества и состава цементирующего газа, механизация процесса.
Нагрев изделий при газовой цементации осуществляется в атмосфере газообразного карбюризатора [например, генераторный газ, полученный при разложении (пиролизе) нефтепродуктов]. При высоких температурах газ распадается с выделением активного углерода, который науглероживает сталь. После газовой цементации изделия также подвергают закалке и низкому отпуску.
Жидкостную цементацию применяют при обработке мелких деталей, когда требуется получить цементированный слой небольшой глубины (не более 0,2...0^3 мм). Жидкостную цементацию выполняют в солевых ваннах, содержащих 75...80 % углекислого натрия и 10...15% хлористого натрия с добавкой 8... 10 % порошка карбида кремния (карборунда).
Азотирование -процесс насыщения поверхности стального изделия азотом для получения очень высокой поверхностной твердости (Нв= 1000... 1100). При этом внутренняя часть изделия сохраняет вязкость. Азотированию подвергают в основном легированные стали, содержащие хром, молибден, алюминий. Перед азотированием изделия проходят механическую и термическую обработку (закалка и отпуск), а после азотирования их шлифуют (на глубину до 0,05 мм). Толщина азотируемого слоя 0,15...0,65 мм.
Азотирование осуществляют в нагревательной печи при температуре 500...520°С. Длительность процесса зависит от требуемой глубины азотируемого слоя и наиболее часто составляет 24...60 ч.
Детали после азотирования не подвергают термической обработке. Твердость азотируемого слоя выше, чем твердость после цементации или закалки, что объясняется наличием в нем нитридов - химических соединений хрома, молибдена, алюминия и железа с азотом. Хрупкость азотированного слоя меньше, чем цементированного и закаленного. Следует отметить, что эта высокаятвердость сохраняется при нагреве до 600...650°С. Кроме того, азотируемые изделия износо- и коррозионно- устойчивы.
Цианирование- стали химико-термическая обработка, заключающаяся в одновременном насыщении стальных изделий углеродом и азотом. При жидком цианировании применяют цианистые натрий, калий и кальций. Основным компонентом является группа циана.
При газовом цианировании (нитроцементации) поверрхность стальных изделий насыщается углеродом н азотом в газовой смеси, состоящей из 70...75 % генераторного пиролизного газа и 2...30 % аммиака.
Диффузионная металлизация- процесс насыщения поверхности стальных изделий металлами: алюминием, бромом, кремнием. После диффузионной металлизации стальные изделия приобретают устойчивость против разъедания щелочами, кислотами и другими химическими веществами, а также против окалинообразования.
Алитирование представляет собой процесс насыщения поверхности стали алюминием для повышения жаростойкости.
Хромирование - насыщение поверхности стали хром для повышения поверхностной твердости, износо и жаростойкости. Хромированию подвергают шейки валов центробежных насосов, напильники, ножовки.
Сульфинирование - насыщение поверхности стальных изделий серой и азотом на глубину 0,2...0,3 мм путем нагрева в расплавленных сероазотистых солях. Сульфипированные изделия хорошо выдерживают длительное трение.
 2015-05-26
2015-05-26 2721
2721
