Из рис. 4 следует, что для того, чтобы давление пара над раствором было таким же, что и над чистым растворителем, необходимо нагреть раствор до более высокой температуры. В соответствии с этим раствор при одинаковом атмосферном давлении закипает при более высокой температуре, чем чистый растворитель. При этом смещение температуры кипения пропорционально содержанию растворенного вещества в растворе:
ΔТкипения = Ткипения раствора – Ткипения растворителя = Е · С, (6)
где С – концентрация раствора, Е – коэффициент пропорциональности.
На рис. 4 кривая OF характеризует зависимость давления насыщенного пара над твердой фазой от температуры. Кристаллизация растворителя начинается при условии, что давление насыщенных паров над жидкостью снизится до величины, соответствующей давлению паров над его кристаллами. При замерзании (кристаллизации) идеального раствора процесс начинается с выпадения из него кристаллов чистого растворителя. Именно температура появления первых кристаллов и принимается за температуру кристаллизации (замерзания) раствора. Как видим из рисунка, понижение температуры кристаллизации раствора пропорционально понижению давления паров чистого растворителя. Поэтому раствор всегда замерзает при более низкой температуре, чем чистый растворитель:
ΔТзамерз. = Тземерз. растворителя – Тзамерз. раствора = К · С, (7)
где С – концентрация раствора, К – коэффициент пропорциональности.
Обычно концентрация раствора при проведении измерений изменения температуры фазовых переходов в растворах определяется в виде моляльной концентрации.
Моляльная концентрация показывает, сколько молей растворенного вещества содержится в 1 кг растворителя. Если g граммов растворенного вещества с молекулярной массой М растворены в G граммах растворителя, то моляльная концентрация такого раствора определяется по формуле
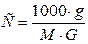 , (8)
, (8)
Физический смысл коэффициентов пропорциональности Е и К ясен из приведенных выше выражений для изменения температуры фазовых переходов. К и Е – представляют собой моляльные изменения температуры соответствующих фазовых переходов (то есть, изменения, происходящие при введении в раствор 1 моля вещества на 1 кг растворителя).
Константа К называется криоскопической постоянной, а константа Е – эбуллиоскопической постоянной. Значения К и Е зависят только от природы растворителя и не зависят от того, какое вещество мы в нем растворяем. Это - очевидно, если учесть, что все рассматриваемые законы относятся к идеальным растворам, то есть растворам, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества.
Теоретически значение констант К и Е может быть вычислено из уравнений:
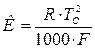 , (9)
, (9)
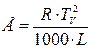 , (10)
, (10)
где ТС – температура кристаллизации чистого растворителя,
TV – температура его кипения,
R – универсальная газовая постоянная,
F – удельная теплота плавления чистого растворителя,
L – удельная теплота его парообразования.
 2015-05-26
2015-05-26 441
441








