Буферное действие основано на связывании компонентами буферной системы поступающих в раствор ионов Н+ и ионов ОН- с образованием слабых электролитов.
Рассчитаем, как изменится рН буферного раствора объемом 1 л с концентрацией уксусной кислоты и ацетата натрия по 0,1 моль/л, при добавлении к нему: а) 0,01 моль HCl; б) 0,01 моль NaOH; в) при разбавлении в 10 раз.
а) При добавлении к буферному раствору HCl избыточные ионы H+ будут связываться ацетат-анионом в молекулы слабого электролита уксусной кислоты:
CH3COO- + H+= CH3COOH
При этом концентрация молекул уксусной кислоты возрастет на 0,01 моль/л, а концентрация ацетат-ионов уменьшится на ту же величину:
[CH3COOH] = 0,1 + 0,01 = 0,11 моль/л
[CH3COO -] = 0,1 – 0.01 =0,09 моль/л
Тогда
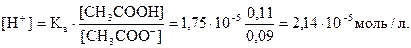
рН = -lg 2,14 10-5 = 4,67
Таким образом, рН буферного раствора снизилось от 4,76 до 4,67, т.е. на 0,09. (Для сравнения: при добавлении 0,01 моль HCl к 1 л воды рН изменяется от 7 до 2, т.е. на 5 единиц).
б) При добавлении к буферному раствору NaOH избыточные ионы ОН – будут взаимодействовать с молекулами уксусной кислоты с образованием слабого электролита воды:
CH3COOH + OH-= CH3COO- + H2O
При этом концентрация молекул уксусной кислоты уменьшится на 0,01 моль/л, а концентрация ацетат-ионов возрастет на ту же величину:
[CH3COOH] = 0,1 - 0,01 = 0,09 моль/л
[CH3COO -] = 0,1 + 0.01 = 0,11 моль/л
Тогда
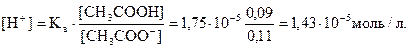
рН = -lg 1,43 10-5 = 4,84
Таким образом, и при добавлении щелочи рН изменяется незначительно (на 0,08).
в) При разбавлении буферного раствора в 10 раз концентрации его компонентов также уменьшаются в 10 раз и, если не учитывать изменение степени диссоциации уксусной кислоты при разбавлении раствора, рН не изменяется:
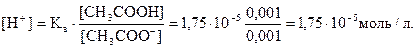
рН = -lg 1,75 10-5 = 4,76.
Способность буферных систем сохранять постоянство рН ограничена и определяется буферной емкостью раствора.
Буферная емкость равна количеству эквивалентов кислоты или щелочи, при добавлении которого рН раствора изменяется на единицу.
Буферная емкость зависит от концентрации компонентов буферного раствора и их соотношения. Она возрастает при увеличении концентрации раствора и достигает максимального значение при равных концентрация его компонентов.
Каждый буферная система имеет свой рабочий интервал рН, за пределами которого буферная емкость резко падает. Для буферного раствора, состоящего из слабой кислоты и ее соли, рабочий интервал рН находится в пределах рKa ± 1.
Пример. Рассчитать буферную емкость по отношению к кислоте раствора, содержащего в 1 л 0,1 моль гидроксида аммония и 0,1 моль хлорида аммония.
рН исходного раствора рассчитываем по формуле:
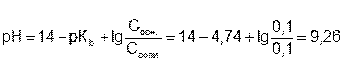
Обозначим буферную емкость раствора по кислоте через х. Таким образом х – это число молей кислоты, которое надо добавит к раствору, чтобы рН уменьшилось на единицу, т.е. стало равным 8,26.
При добавлении х моль HCl к раствору протекает реакция:
NH4OH + H+ = NH4++ H2O.
При этом концентрация NH4OH уменьшится до (0,1 – х), а концентрация NH4+ увеличится до (0,1 + х). Подставляя полученные выражения в формулу для расчета рН раствора, получим:
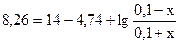
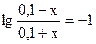
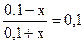
x = 0,082 моль/л
Таким образом, буферная емкость раствора по отношению к кислоте составляет 0,082 моль/л.
 2015-05-26
2015-05-26 4331
4331
