Гидролиз солей – это взаимодействие солей с водой, которое приводит к образованию слабых электролитов.
Гидролиз протекает в том случае, если ионы, образующиеся при диссоциации соли способны вступать в кислотно-основное взаимодействие с водой с образованием слабой кислоты или слабого основания. При этом сдвигается равновесие электролитической диссоциации воды, что приводит к изменению рН раствора.
По характеру гидролиза соли делят на 4 типа.
1. Соль образована катионом сильного основания и анионом слабой кислоты (KCN, Na2CO3, Ca(CH3COO)2 и др.).
Такие соли гидролизуются по аниону, и реакция среды их растворов – щелочная, например:
- KCN + H2O = HCN + KOH
- CN-+ H2O = HCN + OH-
Если соль образована анионом слабой многоосновной кислоты, то гидролиз протекает по ступеням, например:
- Na2CO3+ H2O = NaHCO3+ NaOH
- CO + H2O = HCO3- + OH-
- NaHCO3+ H2O = H2CO3+ NaOH
- HCO + H2O = H2CO3+ OH-
2. Соль образована катионом слабого основания и анионом сильной кислоты (NH4Cl, CuSO4, Zn(NO3)2 и др.).
Такие соли гидролизуются по катиону, и реакция среды их растворов – кислая, например:
- NH4Cl + H2O = NH4OH + HCl
- NH + H2O = NH4OH + H+
Если соль образована катионом слабого многокислотного основания, то гидролиз протекает по ступеням, например:
- ZnCl2 + H2O = ZnOHCl + HCl
- Zn2 ++ H2O = ZnOH ++ H+
- ZnOHCl + H2O = Zn(OH)2 + HCl
- ZnOH ++ H2O = Zn(OH)2 + H+
3. Соль образована катионом слабой кислоты и анионом слабого основания (NH4CN, Fe2(CO3)3, Al2S3 и др.).
Такие соли гидролизуются и по катиону, и по аниону, и реакция среды их растворов близка к нейтральной, например:
- NH4CN + H2O = NH4OH + HCN
- NH + CN-+ H2O = NH4OH + HCN
4. Соль образована катионом сильного основания и анионом сильной кислоты (NaCl, K2SO4, Ba(NO3)2 и др.).
Такие соли не подвергаются гидролизу, так как ни катион, ни анион такой соли не образует при взаимодействии с водой слабых электролитов. Реакция среды растворов таких солей нейтральная.
Гидролиз большинства солей – это обратимый процесс, к которому применим закон действия масс. Например, для реакции гидролиза KCN
CN-+ H2O = HCN + OH-
можно записать константу равновесия:
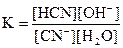 .
.
Концентрация молекул воды в разбавленных растворах практически постоянна, поэтому величина K [H2O] также постоянна и называется константой гидролиза Кг. Константа гидролиза зависит от природы соли и температуры и не зависит от концентрации соли.
Для рассматриваемой соли:
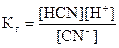 .
.
Умножим числитель и знаменатель правой части уравнения на [OH-]:
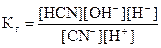
В полученном выражении:
[H+][OH-] = Kw
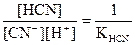 .
.
Таким образом:
 .
.
В общем случае, константа гидролиза соли, образованной катионом сильного основания и анионом слабой кислоты равна отношению ионного произведения воды к константе кислотности слабой кислоты:
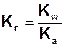
Аналогичные рассуждения для солей других типов приводят к следующим соотношениям.
Константа гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты равна отношению ионного произведения воды к константе основности слабого основания:
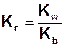
Константа гидролиза соли, образованной катионом слабого основания и анионом слабой кислоты равна отношению ионного произведения воды к произведению констант диссоциации слабой кислоты и слабого основания:
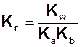
Анализ полученных уравнений показывает, что чем слабее кислота или основание, анион или катион которых входит в состав соли, тем больше значение константы гидролиза и тем полнее идет гидролиз.
При гидролизе соли по ступеням каждой ступени соответствует своя константа гидролиза. Как было показано выше, гидролиз Na2CO3 протекает в две ступени. Первая ступень гидролиза протекает по уравнению:
CO + H2O = HCO3- + OH-
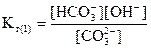
Умножим числитель и знаменатель полученного выражения на [H+]:
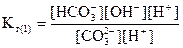
или
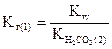 ,
,
где 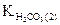 - константа кислотности угольной кислоты по второй ступени.
- константа кислотности угольной кислоты по второй ступени.
Гидролиз по второй ступени идет до образования угольной кислоты:
HCO + H2O = H2CO3+ OH-
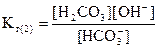
Умножим числитель и знаменатель полученного выражения на [H+]:
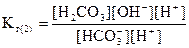
или
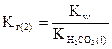 ,
,
где 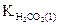 - константа диссоциации угольной кислоты по первой ступени.
- константа диссоциации угольной кислоты по первой ступени.
В общем случае, для соли, образованной анионом слабой многоосновной кислоты:
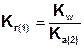
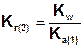
Так как Ka(1) > Ka(2), то Kг(1)>Kг(2). Поэтому в обычных условиях гидролиз по второй ступени практически не идет и при расчетах им можно пренебречь. Это касается и гидролиза солей образованных катионом слабого многокислотного основания и анионом сильной кислоты, для которых
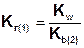
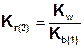 .
.
 2015-05-26
2015-05-26 17726
17726
