Рассчитаем рН буферного раствора, содержащего в 1 л 0,1 моль уксусной кислоты и 0,1 моль ацетата натрия.
Концентрацию ионов водорода вычисляем, исходя из константы диссоциации уксусной кислоты:
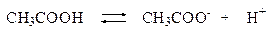
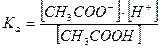
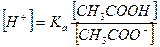
В присутствии ацетата натрия равновесие диссоциации уксусной кислоты сдвинуто влево, поэтому можно считать, что:
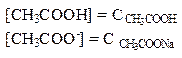
Тогда
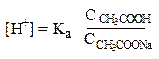
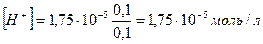
рН = 4,76
В общем случае, для буферного раствора, образованного смешением слабой кислоты и ее соли:
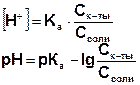
где pKa= - lg Ka.
Рассчитаем рН буферного раствора, содержащего в 1 л 0,01 моль гидроксида аммония и 0,1 моль хлорида аммония.
Концентрацию гидроксид-ионов рассчитаем, исходя из константы диссоциации гидроксида аммония:
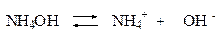
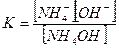
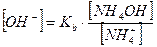
В присутствии хлорида аммония равновесие диссоциации гидроксида аммония смещено влево, поэтому можно считать, что:
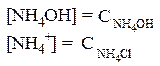
Тогда
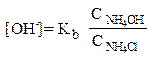
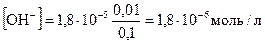
Исходя из ионного произведения воды, рассчитаем [H+] и рН раствора:
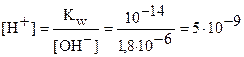 моль/л.
моль/л.
В общем случае, для буферных растворов, образованных смешением слабого основания и его соли:
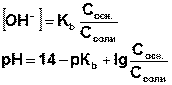
где pKb = - lg Kb, а 14 = - lg Kw
 2015-05-26
2015-05-26 28631
28631








