Связь между количеством выделившегося при электролизе вещества количеством прошедшего через электролит электричества выражается законами Фарадея.
Первый закон Фарадея: массы веществ, выделившиеся на электродах при электролизе, прямо пропорциональны количеству электричества прошедшего через электролит, т.е.
m = k · I · Δt,
где m – масса вещества, образовавшегося на электроде или у электрода, г.
k – электрохимический эквивалент вещества;
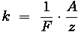
А – молярная масса вещества;
z – валентность;
F = 96487 Кл или F = 26,8 А/ч – постоянная Фарадея;
Δt – время проведения электролиза.
Второй закон Фарадея (закон эквивалентов для электрохимических реакций): одинаковые количества электричества выделяют на электродах при электролизе эквивалентные массы различных веществ:
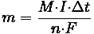 ,
,
где М – молярная масса данного вещества, образовавшегося после электролиза; I- сила тока, пропущенного через вещество или смесь веществ; Δt – время, в течении которого проводится электролиз; n –число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона, принявшего непосредственное участие в электролизе.
Отношение количества электричества (q), необходимого для выделения данной массы вещества, ко всему количеству прошедшего через электролит электричества (Q), называется выходом по току данного вещества и обычно выражается в процентах:
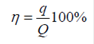 или
или 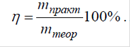
 2015-05-26
2015-05-26 625
625








