Периодическая система элементов Д.И.Менделеева (1869 г.) – система химических элементов, отражающая периодический закон Менделеева – периодическую зависимость физических и химических свойств элементов от их атомного веса (в современной формулировке – от заряда ядра элемента, т.е. от атомного номера элемента в периодической системе элементов). Полное научное объяснение периодической системы элементов осуществлено на основе квантовой механики.
Принцип Паули дает объяснение периодической повторяемости свойств элементов. В соответствии с принципами наименьшей энергии и запрета Паули электроны в атоме распределяются по слоям и оболочкам. Структура периодической системы элементов полностью отвечает порядку заполнения электронных оболочек и слоев в атоме. Порядок заполнения электронных состояний в слоях, а в пределах одного слоя – в оболочках, следует порядку расположения энергетических уровней с данными 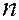 и
и 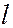 . Сначала заполняются состояния с наименьшей возможной энергией, затем состояния со все более высокой энергией. Этот порядок соответствует тому, что сначала заполняется слой с меньшим
. Сначала заполняются состояния с наименьшей возможной энергией, затем состояния со все более высокой энергией. Этот порядок соответствует тому, что сначала заполняется слой с меньшим 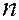 и лишь затем начинается заполнение электронами следующего слоя. В пределах одного слоя сначала заполняются состояния с
и лишь затем начинается заполнение электронами следующего слоя. В пределах одного слоя сначала заполняются состояния с 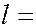 0, а затем состояния с большими
0, а затем состояния с большими 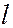 , до
, до 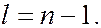 В таблице для 22 элементов таблицы Менделеева показан порядок заполнения электронами слоев и оболочек с ростом порядкового номера элемента в периодической системе элементов. В таблице вместо обозначений
В таблице для 22 элементов таблицы Менделеева показан порядок заполнения электронами слоев и оболочек с ростом порядкового номера элемента в периодической системе элементов. В таблице вместо обозначений 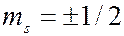 применены символы ↑ и ↓. В полностью заполненных оболочках укзано число электронов в оболочке. Заполненные слои выделены серым цветом.
применены символы ↑ и ↓. В полностью заполненных оболочках укзано число электронов в оболочке. Заполненные слои выделены серым цветом.
| № эле- мента | Символ элемента | СЛОИ И ОБОЛОЧКИ | |||||||||
| К | L | M | N | ||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | ||
| H | ↑ | ||||||||||
| He | ↑↓ | ||||||||||
| Li | ↑ | ||||||||||
| Be | ↑↓ | ||||||||||
| B | ↑ | ||||||||||
| C | ↑↓ | ||||||||||
| N | ↑↓↑ | ||||||||||
| O | ↑↓↑↓ | ||||||||||
| F | ↑↓↑↓↑ | ||||||||||
| Ne | ↑↓↑↓↑↓ | ||||||||||
| Na | ↑↓↑↓↑↓ | ↑ | |||||||||
| Mg | ↑↓ | ||||||||||
| Al | ↑ | ||||||||||
| Si | ↑↓ | ||||||||||
| P | ↑↓↑ | ||||||||||
| S | ↑↓↑↓ | ||||||||||
| Cl | ↑↓↑↓↑ | ||||||||||
| Ar | ↑↓↑↓↑↓ | ||||||||||
| K | - | ↑ | |||||||||
| Ca | - | ↑↓ | |||||||||
| Sc | ↑ | ↑↓ | |||||||||
| Ti | ↑↓ | ↑↓ |
Начиная с калия ( 19) указанный порядок заполнения электронных слоев часто нарушается. Оказывается, что состояния электронов с б о льшими значениями
19) указанный порядок заполнения электронных слоев часто нарушается. Оказывается, что состояния электронов с б о льшими значениями 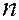 могут иметь меньшую энергию, чем состояния с меньшим
могут иметь меньшую энергию, чем состояния с меньшим 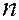
и б о льшим 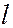 . В результате
. В результате 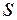 - и
- и 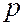 - оболочки следующего слоя начинают заполняться раньше, чем
- оболочки следующего слоя начинают заполняться раньше, чем 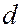 - и
- и 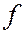 - оболочки предыдущего слоя.
- оболочки предыдущего слоя.
Валентными (внешними) электронами атома называют электроны, входящие в состав 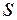 - и
- и 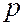 - оболочек слоя с наибольшим числом
- оболочек слоя с наибольшим числом 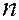 для данного атома. В таблице они расположены над выделенными серым цветом слоями. Число валентных электронов с ростом порядкового номера элементов периодически повторяется. Например, у элементов
для данного атома. В таблице они расположены над выделенными серым цветом слоями. Число валентных электронов с ростом порядкового номера элементов периодически повторяется. Например, у элементов 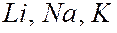 и др. по одному валентному электрону; у элементов
и др. по одному валентному электрону; у элементов 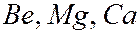 и др. – по два и т.д. Валентные электроны определяют химические и оптические свойства атомов. Периодическая повторяемость электронных конфигураций сверх полностью заполненных слоев (или оболочек) обусловливает периодическую повторяемость химических и оптических свойств элементов.
и др. – по два и т.д. Валентные электроны определяют химические и оптические свойства атомов. Периодическая повторяемость электронных конфигураций сверх полностью заполненных слоев (или оболочек) обусловливает периодическую повторяемость химических и оптических свойств элементов.
Максимальное суммарное число электронов в 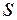 -
- 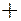
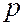 - оболочках равно 8. В основе большинства химических реакций лежит механизм отдачи или присоединения атомами валентных электронов. Энергетически оказывается выгодными отдача валентных электронов атомами с менее чем наполовину заполненными
- оболочках равно 8. В основе большинства химических реакций лежит механизм отдачи или присоединения атомами валентных электронов. Энергетически оказывается выгодными отдача валентных электронов атомами с менее чем наполовину заполненными 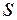 -
- 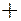
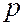 - оболочками и присоединение электронов атомами с более чем наполовину заполненными
- оболочками и присоединение электронов атомами с более чем наполовину заполненными 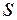 -
- 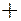
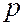 - оболочками. Атомы с наполовину заполненными
- оболочками. Атомы с наполовину заполненными 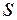 -
- 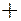
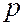 - оболочками могут в зависимости от ряда условий либо отдавать, либо присоединять электроны. Атомы с полностью заполненными
- оболочками могут в зависимости от ряда условий либо отдавать, либо присоединять электроны. Атомы с полностью заполненными 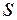 -
- 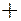
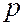 - оболочками являются инертными газами
- оболочками являются инертными газами 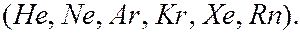
Контрольные вопросы для самоподготовки студентов:
1. Перечислить квантовые числа. Что характеризуют квантовые числа? Какие значения они могут принимать?
2. Что такое спин электрона?
3. Сформулируйте принцип запрета Паули.
4. Как распределяются электроны в атоме по состояниям?
 2015-05-30
2015-05-30 1150
1150
