К условиям, определяющим патогенность факторов, воздействующих на нервную систему (факторы риска) относят интенсивность, длительность, частоту и периодичность воздействия, а также состояние нервной системы в момент действия патогенного агента и состояние гематоэнцефалического барьера.
• Интенсивность, длительность, частота и периодичность воздействия. Значительные и труднообратимые нарушения нервной деятельности могут возникать не только под влиянием сильных, но и слабых патогенных факторов при определённых режимах их воздействия. Например, небольшие дозы алкоголя, наркотиков, ЛС при достаточной продолжительности и частоте их потребления способны вызывать грубые нарушения ВНД, движений, чувствительности и другие нейрогенные расстройства.
• Состояние нервной системы в момент действия патогенного агента. Состояние нервной системы в момент действия патогенного агента определяется её генетическими особенностями (например, типом ВНД) и предшествующими структурно‑функциональными повреждениями. Клинические проявления последних к моменту действия данного патогенного фактора могут быть компенсированными (скрытыми) или носить характер следовых реакций, На таком фоне патогенность повреждающих воздействий увеличивается.
|
|
|
• Состояние гематоэнцефалического барьера. Патологическая проницаемость гематоэнцефалического барьера для экзо‑ и эндогенных факторов может возникать при действии ионизирующей радиации, интоксикации спиртами, микробными токсинами, в условиях охлаждения организма, развития тяжёлых стрессовых ситуаций, различных шоковых состояний. Особое значение повышение проницаемости гематоэнцефалического барьера имеет для нарушения иммунной автономии головного мозга и развития вследствие этого состояний иммунной аутоагрессии с поражением нервной системы (например, рассеянного склероза, энцефаломиелита).
Общий патогенез расстройств нервной деятельности
В этом разделе рассмотрены механизмы повреждения нейронов и нарушения межнейронных взаимодействий, а также механизмы расстройств интегративной деятельности нервной системы.
Повреждение нейронов
Механизмы повреждения нейронов могут носить специфический и неспецифический характер.
Неспецифические механизмы повреждения нейронов
Общие механизмы повреждения клеток рассмотрены в главе 4 «Патология клетки». Такие неспецифические механизмы повреждения нейронов представлены на рис. 29–2.
Ы Вёрстка Файл «ПФ Рис 28 02 Основные механизмы повреждения нейронов Неспецифические»
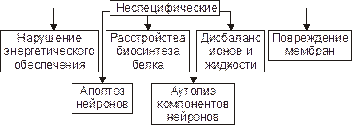
Рис. 29–2. Основные механизмы повреждения нейронов (неспецифические).
|
|
|
• Нарушения энергообеспечения. Возникают при уменьшении поступления в мозг глюкозы и кислорода, снижении активности ферментов биологического окисления, разобщении процессов окисления и фосфорилирования, нарушениях транспорта энергии и расстройствах процессов использования энергии.
† Уменьшение поступления в клетки глюкозы и кислорода.
Наиболее частые причины: гипоксемия, гипогликемия, анемия, снижение мозгового кровообращения, увеличение диффузионного пути глюкозы и O2 от микрососуда до нейронов (при отёке мозга).
Глюкоза является основным энергетическим субстратом нервных клеток. Аэробное расщепление субстратов обеспечивает образование примерно 80% энергии, потребляемой мозгом.
В норме головной мозг утилизирует около 20% глюкозы плазмы крови и всего потребляемого организмом кислорода.
Мозг чрезвычайно чувствителен к сокращению поступления кислорода.
Наличие в нервных клетках гликогена как резервного источника энергии лишь отчасти обеспечивает функционирование жизненно важных отделов нервной системы.
В конечном итоге дефицит глюкозы и кислорода приводит к гибели нервных клеток, в первую очередь нервных клеток коры головного мозга (корковые нейроны погибают при аноксии и при отсутствии глюкозы в течение минут).
† Снижение активности ферментов биологического окисления. Наиболее частые причины: ингибирование и/или денатурация ферментов (например, при отравлении цианидами и солями тяжёлых металлов, при эндогенной интоксикации), недостаточность ферментов (например, при генетических дефектах, авитаминозах B1, B2), нарушение компартментализации (например, при дезорганизации мембран митохондрий под воздействием ионизирующей радиации, высокой температуры, продуктов нарушенного обмена).
† Разобщение процессов окисления и фосфорилирования. Наиболее частые причины: избыток в нейронах Ca2+ и накопление жирных кислот.
† Нарушение транспорта энергии от мест образования макроэргических соединений до мест расходования энергии. Одна из наиболее частых причин: потеря нейронами BB‑фракции КФК при повреждении их мембран.
† Расстройство процессов использования энергии. Наиболее частая причина: снижение активности АТФаз (в условиях ацидоза, интоксикации, ионного дисбаланса).
• Расстройства синтеза белка.
† Наиболее частые причины: дефицит аминокислот, нарушения энергообеспечения, снижение активности ферментов протеосинтеза, распад синтезирующего белок органоида — шероховатой эндоплазматической сети (субстанции Ниссля).
† Проявления. Расстройства синтеза белка приводят к катастрофическим последствиям для всех стороны жизнедеятельности нервных клеток и — в итоге — к их гибели.
• Дисбаланс ионов и жидкости. Ионный гомеостаз нейронов обеспечивается работой энергозависимых калиевых, натриевых, кальциевых и других ионных каналов.
† Типичные проявления ионного дисбаланса (возникающие, например, при энергодефиците): накопление Na+ и Ca2+ в нейронах и избыток K+ во внеклеточном пространстве.
† Последствия: стойкая деполяризация плазмолеммы нейрона (приводит к прекращению нормальной функции нервных клеток), повышение осмотического давления в нейронах, их набухание и последующая гибель.
• Повреждение мембран нейрона. Этот процесс является универсальным механизмом большинства нарушений нервной деятельности.
† Наиболее частые причины: чрезмерное образование активных форм O2 и усиления СПОЛ, активации эндогенных фосфолипаз, механическое растяжение мембран, воздействие на мембраны амфифильных соединений.
† Последствия. Повреждение мембран возбудимых клеток быстро приводит к прекращению их функциональной активности (электрогенез), нарушению всех проявлений жизнедеятельности нервных клеток (например, синаптическая передача, синтез белка, аксонный транспорт и др.) и их гибели путём аутолиза и апоптоза (см. раздел «Гибель клетки» в главе 4 «Патология клетки»).
|
|
|
• Апоптоз. Важная роль апоптоза — генетически контролируемого процесса гибели нейронов — доказана для многих форм невропатологии, особенно для нейродегенеративных заболеваний (например, для болезней Паркинсона, Альцхаймера; старческой деменции; бокового амиотрофического склероза и др.).
† Причины: гипоксия нервной ткани любого типа, особенно действующая длительное время (например, при атеросклерозе церебральных сосудов; опухолях головного или спинного мозга, сдавливающих сосуды), внутриклеточный ацидоз (например, при значительной ишемии ткани мозга), избыточная генерация радикалов кислорода, липидов и других веществ в ткани мозга (например, в условиях гипоксии и/или гипероксигенации мозга, отравлении нейротоксическими агентами).
† Механизмы апоптоза изложены в разделе «Апоптоз» в главе 4 «Повреждение клетки».
Описанные выше механизмы повреждения нейрона тесно взаимосвязаны, они нередко потенцируют друг друга, образуя порочные круги (circulus vitiosus). Формирование таких порочных кругов — неспецифическая, стандартная реакция нейрона на разные патогенные воздействия.
 2015-05-22
2015-05-22 606
606








