Цинк является электроотрицательным металлом (EoZn2+/Zn= -0,76 В). Однако вследствие очень маленьких токов обмена для выделения водорода на цинке (io = 1×10-11 А/см2 при io,Zn =1×10-5 А/см2) кривые поляризации цинка идут значительно круче, чем водорода. Это дает возможность осаждать цинк из кислых растворов при повышенных iк с приемлемыми выходами по току (рис.4.4).
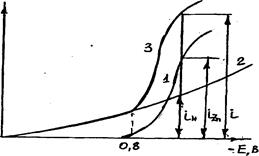
Рис.4.4. Схема кривых поляризации выделения водорода и цинка из раствора, содержащего 60г/л Zn2+ и 100 г/л Н2SО4:
1 - поляризационная кривая (ПК) процесса Zn2+ + 2е = Zn;
2 - процесса H+ + е = Н; 3 - суммарная ПК: i = iн +iZn
Реакция на катоде (алюминий):
ZnSО4 + 2е = Zn + SO42- (4.16)
На аноде (Pb либо Pb-Ag) имеет место реакция выделения кислорода:
Н2О - 2е = 2Н+ + 1/2О2 (4.17)
Суммарная реакция при электролизе:
ZnSО4 + Н2О == Zn + 1/2О2 + H2SО4 (4.18)
В электролизеры непрерывно поступает нейтральный электролит, содержащий 100-150 г/л Zn2+, а из электролизеров вытекает кислый "отработанный" электролит, содержащий 40-60 г/л Zn2+ и 120-160 г/л H2SО4. При более низкой концентрации Zn2+ и более высокой концентрации серной кислоты выход по току резко снижается.
На процесс электролиза большое влияние оказывает температура. Ее повышение снижает быстрее перенапряжение выделения водорода, чем цинка, что отрицательно сказывается на выходе по току. На практике электролиз ведут при температурах не выше 35-40°С (применяют принудительное охлаждение).
Выделяющийся кислород может приводить к аэрозольному распылению электролита (образование "сернокислотного тумана"). Для предотвращения этого явления в электролит вводят пенообразователи (мыльный корень).
Общее напряжение на электролизере составляет 3,1-3,8 В. Баланс напряжения приведен в табл.4.2.
Таблица 4.2
 2015-05-22
2015-05-22 675
675








