Никель является основой жаростойких, коррозионно-стойких сплавов и сталей. Шлам электрорафинирования никеля представляет собой ценное сырье для получения платиновых металлов.
Стандартный потенциал никеля EoNi2+/Ni = -0,23 В. Ток обмена на границе раздела никель - электролит очень мал (10-8-10-11 А/см2), поэтому разряд ионов никеля сопровождается большой поляризацией. Разряд же ионов водорода на никеле происходит с небольшим перенапряжением (io= 5×10-6 А/см2). Процесс деполяризуется за счет растворения выделяющегося водорода в никеле с образованием гидрида никеля. В 100 г никеля растворяется 200-300 см3 водорода.
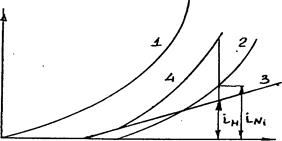
Поляризационные кривые для разряда ионов Н+ и Ni2+ при различных рН раствора приведены на рис.4.1.
-0,16 –0,23 E
Рис.4.1.Поляризационные кривые разряда ионов Н+ и Ni2+
при различных рН раствора: l-H++e=H(pH=0);2-Ni2++2e=Ni;
3-H++e=H(pH=3);4- суммарная поляризационная криваяi=iH+iNi
Видно, что при рН=0 обеспечить высокий выход никеля по току не удастся. При рН=3 появляется возможность преимущественного выделения никеля. При рН=4 выход по току близок к 100%. При повышении температуры выход по току возрастает.
Ввиду малого тока обмена анодное растворение никеля, так же как и разряд его ионов, сопровождается значительной поляризацией. Кроме того, никель легко пассивируется. При этом его растворение прекращается и на аноде начинает выделяться кислород. Для устранения пассивации в электролит вводят 30-80 г/л Сl-, а для повышения электропроводности - 90-100 г/л Na2S04.
Из-за большой анодной поляризации на аноде происходит ионизация не только электроотрицательных металлов (Zn, Fe, Co), но и более электроположительных (Сu, Рb). Для того чтобы предотвратить загрязнение ими катодного никеля, анолит подвергают химочистке: от железа и кобальта с помощью реакций гидролиза
Fe2(SО4)3+6H2О=2Fe(OH)3+3H2SО4 (pH=3,5); (4.13)
Сo2(SО4)3 + 6Н2О = 2Со(ОН)3 + 3H2SО4 (рН = 2,5); (4.14)
от меди - цементацией на никеле:
Cu2++Ni= Ni2+ +Cu (4.15)
Очищенный электролит подают в катодное пространство, отделенное от анодного переточной брезентовой или перхлорвиниловой диафрагмой (рис.4.2).
Скорость перетока электролита должна быть больше скорости миграции.
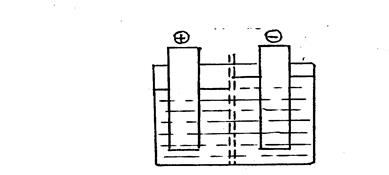
Рис.4.2. Схема электролизера с переточной диафрагмой
Исходный никель содержит 90-92% основного металла, 2-5% Сu, 2-2,5% Fe, 1-1,5%Со, 0,7-1% S. Из него отливаются аноды массой 250-350 кг.
Состав электролитов и условия электролиза на различных заводах приведены в табл.4.1.
Таблица 4.1
 2015-05-22
2015-05-22 1055
1055








