Лишь небольшая часть веществ поглощает излучение в видимой области спектра, и несколько большая часть веществ в УФ области. Причем интенсивность окраски неорганических ионов в свободном состоянии в водных растворах столь незначительна, что серьезного аналитического значения она иметь не может. Например, аквакомплекс меди окрашен, но анализировать можно только 0,1 М и 1 М растворы, т. е. о концентрации 10-5 М речи быть не может.
Что же можно анализировать в видимой и УФ областях спектра? Большое количество красителей поглощает в видимой области спектра, хинонные структуры, нитропроизводные, в подавляющем большинстве полиметиновые красители с чередующимися двойными и одинарными связями.
Из неорганических веществ аналитическое значение имеет поглощение в чистом виде, в основном, это соединения хрома и марганца – хромат и перманганат.
В УФ-области спектра поглощают соединения, содержащие бензольные, фенольные кольца. Правда, e для этих соединений невелико. Для бензола спектральные характеристики таковы: e = 180 при λ = 260 нм. Это глубокий ультрафиолет, и при нем трудно работать.
В этих областях спектра поглощают еще соединения, содержащие кетонную и альдегидную группировки, но характеристики их еще более слабые: e примерно равно 20 при λ 240 нм.
Надо отметить, что даже такие спектральные характеристики имеют значение в аналитике и могут применяться, но не в индивидуальном виде, а в сочетании с хроматографией, особенно в варианте жидкостной хроматографии.
Подавляющее большинство веществ (99 % всех соединений в фотометрии) переводят в окрашенные соединения с помощью тех или иных химических реакций.
Для этой цели применяют целый ряд различных типов химических реакций. Для водных растворов это прежде всего реакции:
1. комплексообразования,
2. окисления-восстановления, но очень редко, хромат-бихромат-ионы
3. органические реакции различных типов,
4. экстракционно-фотометрические реакции.
Последний тип реакций вам менее известен, хотя элементы мы применяли на практике, но глубоко не разбирали. Особенно широко поставлен биохимический молекулярно-абсорбционный анализ с помощью различных реакций.
Формулу глюкозы вы помните? Вы знаете хотя бы одну из реакций, которая переводит бесцветную глюкозу в окрашенное состояние? А глюкозу анализировать очень важно.
Итак – классика: реакция комплексообразования.
Наиболее типичный пример – это медь с аммиаком:

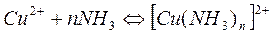
Образуется обращенный комплекс, имеющий различную интенсивность окраски в зависимости от концентрации аммиака: e = 100 при λ = 600 нм. Не блестяще, но уже кое-что.
Более интересная и известная вам реакция – это роданид с железом:
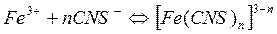
Получаем соединение с e, изменяющимся в зависимости от числа лигандов n, но в оптимальных условиях составляющем около 5000 единиц.
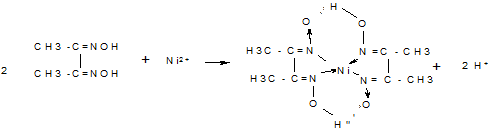 |
Еще более интересными являются реакции целого ряда металлов с органическими реагентами. Это реакция Ni2+ c диметилглиоксимом
Диметилглиоксимат никеля при очень малых концентрациях растворим, и поглощает красное излучение.
Fe2+ определяют с ортофенантролином – этот комплекс имеет e = 20000 ед. при λ = 540 нм.
Надо отметить, что за сравнительно долгое время было синтезировано около 10000 органических реагентов, дающих окрашивающие соединения с теми или иными элементами. Например, на медь разработано более сотни реагентов, и с их помощью разработаны методики для определения. Это классические соединения, комплексные – краун-эфиры, порфирины, целый ряд соединений.
Прежде чем рассмотреть органические реакции, рассмотрим экстракционно-фотометрические реакции. Принципиально новые возможности открываются при проведении многих реакций в двухфазной системе вода – органический растворитель. Причем обычно реагент и определяемое вещество вносят в водную фазу такой системы, а образующееся окрашенное соединение локализуется преимущественно в органическом растворителе. Такая двухфазная система называется экстракционной, а метод анализа экстракционно - фотометрическим.
Наиболее ярко это можно проиллюстрировать на примере определения алюминия с оксихинолином в двухфазной системе вода - хлороформ.
При проведении же реакции алюминия с оксихинолином в водной фазе этому определению мешает целый ряд элементов: все переходные металлы, кальций, магний и другие, т.е. определение не селективно.
В двухфазной системе реакцию проводят следующим образом: пробу, содержащую алюминий и реагент, вносят в водную фазу. Туда же вносят аце
татный буферный раствор, имеющий рН = 5, и прибавляют хлороформ. Встряхивают смесь в делительной воронке 5-10 минут. При этом протекает реакция:
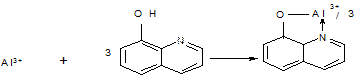 |
(С9Н6NO)3Al
Оксихинолят алюминия в отличие от других оксихинолятов переходит в хлороформную фазу, окрашивая ее в желтый цвет, e составляет 8000, при λ = 420 нм. Это и есть экстракционно-фотометрическая реакция.
Таким образом, благодаря проведению реакции в двухфазной системе удается повысить селективность на фоне целого ряда металлов. Кроме того, если в анализируемом растворе были окрашенные примеси, то было бы проблематично определение алюминия в воде. Окрашенные примеси не обязательно будут экстрагироваться хлороформом, таким образом, существенно увеличиваются возможности определения.
Есть еще один важный момент проведения экстракционно-фотометрических реакций – можно не только получить аналитико-активнуюформу, но и существенно сконцентрировать определяемое вещество в 10 – 100 раз, в редких случаях в 1000 раз.
Это можно сделать так: взять один небольшой объем хлороформа и 500 мл пробы, например, воды, и тогда из 500 мл элемент перейдет в хлороформ.
Чаще всего в качестве растворителей используются не слишком инертные, несмешивающиеся с водой или ограниченно смешивающиеся с водой органические растворители:
- спирты, начиная с бутилового, изобутилового, амиловый;
- все галоидуглеводороды, прежде всего хлоруглеводороды, такие как хлороформ, дихлортан, четыреххлористый углерод;
- ароматические соединения – бензол, толуол, ксилол.
- иногда используют эфиры уксусной кислоты высших спиртов бутилового и амилового (изобутилацетат, изоамилацетат). Бутилацетат тоже не смешивается с водой, но находится на грани смешивания.
- альдегиды очень редко используются в экстракции.
- используются некоторые кетоны: метилэтилкетон, метилбутилкетон, но они очень дорогие.
Это основные растворители, которые используются в экстракции такого типа.
Еще более интересными являются эктракционно-фотометрические реакции, основанные на использовании специальных красителей кислотных и основных, широкая гамма которых была синтезирована в середине прошлого века и используется в качестве пигментов. Широко используются в аналитике такие вещества, как фуксин, родамин, бромкрезоловый зеленый, кристаллический фиолетовый, метиловый фиолетовый и другие.
Алифатические углеводороды были бы идеальными растворителями, например октан, нонан, декан. Они мало летучи, но в них плохо идёт экстракция. Они обладают низкими экстракционными свойствами для подавляющего большинства случаев, поэтому они используются реже.
Проблемный пример, который я вам уже приводил, это определение алюминия с оксихинолином, в результате которого образуется оксихинолят алюминия в водной фазе в виде осадка или очень разбавленного раствора, если концентрация мала. Далее он экстрагируется в хлорофорную фазу, придавая ей окраску.
Хотел бы обратить ваше внимание на то, что это самый простой тип применения экстракции. Аналитико-активная форма образуется даже в водной фазе, т. е. эту реакцию экстракции нельзя признать реакцией образования аналитико-активной формы.
Гораздо более интересными являются реакции экстракции ионных ассоциатов, образуемых катионами органических оснований и анионами органических красителей, либо наоборот, анионами органических кислот и катионами органических красителей.
Все такие красители делятся на два типа: катионные и анионные, в зависимости оттого, что они дают в воде: гидрофильный катион или гидрофобный анион.
По этой схеме в водную фазу вносится определяемый катион либо анион и реагент – краситель, дающий гидрофобный ион, имеющий противоположный знак заряда по отношению к определяемому иону.
Наиболее ярким примером такой реакции, которая широко используется в экологии, является определение анионных ПАВ с метиленовым голубым. Анионные ПАВ – это эфиры серной кислоты - алкилсульфаты и алкилсульфонаты.
Все эти соединения в водной фазе хорошо растворимы и диссоциируют, образуя гидрофобные анионы. В случае алкилсульфатов – это ROSO3-, где R – для средних ПАВ – C12.. Метиленовый голубой – это краситель, имеющий следующую структуру:
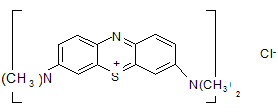 |
В этом соединении азот связан по краям с двумя метильными группами -СH3, бензольное и хинольное кольца сшиты атомами азота и серы посередине.
Метиленовый голубой в водном растворе находится в виде хлоридной соли и диссоциирует на гидрофильный анион CI- и гидрофобный катион метиленового голубого. В водной фазе при высоких концентрациях может образоваться гидрофобный осадок катиона метиленового голубого и аниона алкилсульфата, однако в разбавленных растворах никакой реакции не происходит. При наличии органической фазы, например хлороформа (хлороформ стандартный растворитель для этой реакции), происходит экстракция в хлороформ ионной пары гидрофобных аниона и катиона.
Процесс описывается законом действия масс с константой, которая называется константой экстракции ионных асоциатов:
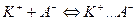
водная фаза органическая фаза
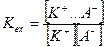
В данном случае константа экстракции не очень высока и для её смещения в сторону ионного ассоциата необходим большой избыток метиленового голубого.
Иногда это определение выполняют несколько по–другому: берут небольшой избыток метиленового голубого, но извлекают хлороформом не однократно, а 3 - 4 раза для полноты извлечения. Технически это легко осуществимо. Берётся делительная воронка, в неё помещаются обе фазы, проводят встряхивание руками, органическая фаза окрашивается, уравновешивается, далее её сливают и добавляют новую порцию органической фазы, опять встряхивают, опять сливают и так и так 3 – 4 раза, до тех пор, пока следующая порция уже не будет окрашиваться. Тогда объединяют экстракт и фотометрируют его.
Несколько слов о природе ионного ассоциата. Вы знаете, есть молекулы и ионы, а ионный ассоциат – это третье состояние вещества. Ионные ассоциаты имеют при ближайшем рассмотрении некоторые особенности. По своим спектральным характеристикам ионы в ионных ассоциатах близки к ионам в водных растворах. Например, цвет метиленового голубого в воде и экстракта будут практически одинаковыми. Это означает, что положительный заряд на азоте остаётся в ионном ассоциате, как и в ионе.
Вместе с тем, отличительной особенностью ионных ассоциатов является отсутствие основного показателя ионов – электропроводности. Электропроводность ионных ассоциатов очень мала. Они диссоциируют в органических растворителях на ионы, но очень слабо. Ионные ассоциаты могут быть образованы только в средах с низкой диэлектрической проницаемостью, когда диэлектрическая проницаемость ниже 20. В нитробензоле ещё мало ионных ассоциатов, диэлектрическая проницаемость его 35. Вода имеет диэлектрическую проницаемость 81, ионных ассоциатов практически нет. Зато в хлороформе диэлектрическая проницаемость которого 4,5, в толуоле, диэлектрическая проницаемость которого 2,8, высшие спирты, например изоамиловый, имеет диэлектрическую проницаемость 14, ионные ассоциаты образуются довольно хорошо.
Таким образом, ионные ассоциаты – это такое состояние вещества, когда есть ионы, но ионы находятся в состоянии взаимодействия друг с другом и перемещаются в виде ионного ассоциата. Энергия их взаимодействия существенно выше их теплового движения. Ионные ассоциаты обычно обозначают как пару ионов – катион и анион, соединённых электростатическими связями, т. е. их обозначают точками …, как вы видели у метиленового голубого.
Катионов красителей, которые могут применяться для этой задачи, и для определения других гидрофобных анионов, весьма много: метиленовый фиолетовый, кристаллический фиолетовый, бриллиантовый зелёный, фуксин, эозины и ещё большое количество. Все они относятся к двум группам структур: это диарилметановые красители (их представитель метиленовый голубой) и триарилметановые красители.
 |
Структура бриллиантового зелёного:
 |
Если –C2H5 заместить на –CH3, то получим метиленовый зелёный:
Эти красители приведены в справочной литературе, их около двух сотен. А определяемые с их помощью вещества приведены в справочнике Лурье.
Кроме этих структур выделяются ксантеновые красители.
Один из них родамин С:
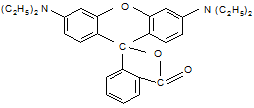 |
К ксантеновым красителям относятся метил- и бутилродамин.
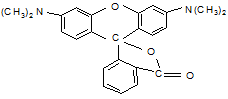 |
Формула метилродамина следующая:
Наличие окраски во всех этих красителях объясняется наличием хиноидной структуры, образующей систему чередующихся двойных связей. Через центральный атом углерода связь передаётся на два бензильных радикала.
С катионными красителями, кроме алкилсульфатов, определяют широкую гамму металлов, образующих гидрофобные анионные комплексы: это Au(Hal)4; Ta(Hal)4; BF4; Hg(Hal)3; Cd(Hal)4; Zn(CNS)4; Co(CNS)4, германий образует пергалоидные комплексы.
Можно определять и галоиды, например J3-, BrJ2-, J5-, CIBr2-, (полигалоидные комплексные соединения). В качестве катионных красителей чаще всего используют метиловый оранжевый, который относится к диарилметановым красителям, и бромкрезоловый зелёный, относящийся к классу триарилметановых красителей.
Формула метилового оранжевого:
 |
Таких красителей в зависимости от заместителей известно много, более 40. Бромкрезоловый зелёный выделяется из них, так как он наиболее удобен для экстракционно – фотометрических определений.
Формула бромкрезолового зеленого:
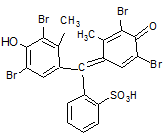 |
По сульфогруппе – это сильная кислота: Кдис = 0,2, а по OH – группе – слабая кислота: К2дис = 10-5 Поэтому бромкрезоловый зелёный известен как pH индикатор с рКперехода = 5, при этом наблюдается переход из жёлтой окраски однозарядного аниона в синюю окраску двухзарядного аниона.
В экстракциионных ассоциатов наибольший интерес представляет однозарядный анион, как, впрочем, и для всех остальных сульфокрасителей триарилметанового ряда.
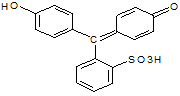 |
Простейший из них – феноловый красный, в нём отсутствует -Br, -CH3:
Далее идёт крезоловый красный, Br- – отсутствует:
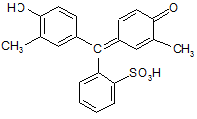 |
Бромкрезоловый пурпурный:
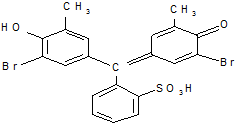 |
Хлорбромкрезоловый:
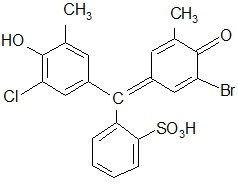 |
и целый ряд других.
Анионные красители используются в практике для определения гидрофобных катионов. Например, почти все тяжелые металлы цинк, никель, кобальт, железо, марганец, кобальт и другие двухзарядные металлы можно определить по следующей схеме: они образуют диаминные комплексы, наиболее часто ортофенонброминатные.
В результате реакции с диамином образуется комплексная частица [Ме(ДА)2]2+ с зарядом, равным заряду металла, т. к. диамин существует в молекулярной форме:
Ме2+ + 2ДА ® Ме[(ДА)2]2+
Далее в водную фазу вносят краситель бромкрезоловый зелёный в жёлтой форме (в форме однозарядного аниона). В хлороформной фазе при этом появляется ионный ассоциат следующего строения:
[Ме(ДА)2]2+ + БКЗ G [Ме(ДА)2]2+···(БКЗ)2
Соединение ортофенантролина с металлами имеет следующую структуру:
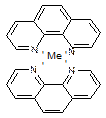 |
Металлы с катионными красителями определяют реже, чем органические основания, дающие гидрофобные катионы. Это все алкалоиды, включая героин, кодеин, морфин, димедрол, папаверин, эфедрин, многие лекарственные препараты и наркотики. Все эти соединения, а также многие другие, например соединения обездвиживатели: миорелаксанты (курареподобные вещества), которые могут обездвиживать мышцы дыхания (наступает смерть), либо другие мышцы (у животных в зоопарках) – это тоже органические основания. Миорелаксанты - высшие бисчетвертичные аммонийные соли, а алкалоиды – это обычно амины, а применяют их в виде хлоридных сложных аминов. Одна из работ нашего практикума – это определение димедрола с метиловым оранжевым, как красителем катионным, анионным, сульфодиарил-металлами. Кроме этого – классические основания. Это все амины – первичные, вторичные, третичные. Хуже определяются ароматические амины, а также четвертичные аммониевые соли – триэтил-, тетраэтил-, тетрапропил-, тетрабутил-аммония и т. д.
Хочу привести вам интересную реакцию, которая до сих пор мне не даёт покоя своей «неразгаданностью», которую мы 20 лет назад обнаружили, но не до конца её обследовали. Против этой реакции все активно возражали: этого не может быть!
Реакция идёт по такой схеме:
8 M H2SO4
Sb + 3I- à SbI3
В толуол этот иодид экстрагируется с коэффициентом > 100. Образующийся иодид в толуоле хорошо реагирует с молекулярной формой
основания родамина С с образованием соединения:
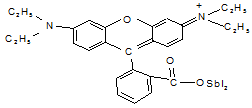 |
По окраске напоминает окраску катиона родамина С.
При этом идёт раскрытие цикла и восстанавливается хинонная структура. Роль катиона водорода играет частица SbJ2+, а роль аниона - оставшийся J-. Но это не доказано.
Остановимся на определении неионогенных ПАВ. Катионные ПАВ можно определять с анионными красителями.
Рассмотрим следующую реакцию, которая была применена впервые:
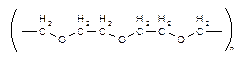 |
CoCI2 + KCNS + (неионогенные) ПАВ ® образуется интенсивная синяя окраска. Неионогенные ПАВ это:
Число атомов углерода может быть 10-20 и т. д.
Катионы калия обкручиваются этим циклом. Шесть кислородов на одном атоме калия. Если кислородов 40, то 6 – 7 атомов калия. Образуются гидрофобные катионы, далее они реагируют с Co(CNS)2-. В результате появляется окраска.
До открытия краун – эфиров объяснить это было нельзя. Только с появлением краун – эфиров было найдено объяснение.
Надо отметить, что калий тоже можно определить с краун – эфирами. Есть фотометрическая реакция определения калия, в результате которой образуется окрашенное соединение.
Перейдём к очень важному способу определения соединений с помощью различных органических реакций.
Можно порекомендовать очень «сильную» монографию Коренмана «Фотометрический анализ органических соединений». В ней приведено более 100 различного типа реакций на определение почти всей органики фотометрически.
Спирты – это бесцветные соединения, не поглощающие в УФ, близком, даже жёстком. Спирты переводят в нитросоединения или в алкилнитриты. Применяется реакция нитрозирования. Нитрозирующая смесь – это KNO2 и HCI, образуются алкилнитриты, соли и вода:
ROH + KNO2 + HCI ® R-O-N=O + KCI + H2O
Aлкилнитриты в зависимости от алкила поглощают близкое УФ- излучение в диапазоне 340 – 370 нм. e невысокое - 70, несколько изменяется в зависимости от R (первичные, вторичные или третичные).
Эти спектральные характеристики далеко не блестящие, низкое значение e. Но эта реакция широко применяется для определения спиртов, т. к. это единственно точный количественный метод для определения концентрации спиртов. Надо отметить, что наиболее часто эта реакция используется для определения высших спиртов, начиная от С5 и выше, потому что образующиеся нитриты (гексил и т. д.) можно проэкстрагировать октаном, отделив таким образом от поглощающих УФ – излучение нитритов с помощью обработки раствором щёлочи.
Следующая реакция, которая позволяет получить эффективные поглощающие среды. – это реакция нитрования.
Перед вами реакция нитрования фенола до пикриновой кислоты:
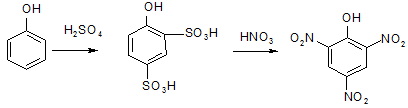 |
Сначала образуется орто-пара-дикислота, затем идёт замещение на три нитрогруппы. Сама пикриновая кислота в молекулярной форме в видимой области спектра крайне плохо поглощает свет, однако анион пикриновой кислоты имеет весьма хорошие спектральные характеристики: e = 14000 в близком УФ --358 нм и в видимой области - 410 нм e = 9100.
Вы, наверное, читали про пикриновую кислоту. Знаете, как по – японски называется пикриновая кислота? Шимоза. Новиков хорошо описывает, как японцы, используя шимозу, сжигали русские суда эскадры адмирала Рождественского.
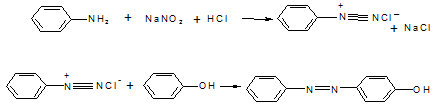 |
Ещё один тип реакций, который очень широко применяется для определения большого класса веществ – это реакции диазотирования:
На первой стадии получается соль диазония, нестойкое соединение, которое является реагентом, которое получают непосредственно перед проведением реакции. Если соль диазония вступает в реакцию с фенолом (сам фенол тоже поглощает излучение, но его спектральные характеристики значительно хуже: e = 180 при l = 260 нм), то образуется соединение с системой чередующихся двойных связей, которые обеспечивают появление окраски.
Эти соединения – красители, они имеют e = 104 – 105 в видимой области спектра. Их может быть много в зависимости от заместителейна бензольных кольцах, как реагента, так и определяемого вещества, вступающего в реакцию.
Реакции диазотирования используют для определения различных ароматических соединений, прежде всего фенолов, аминов и других, в том числе и в биохимическом анализе для определения билирубина.
Родамины
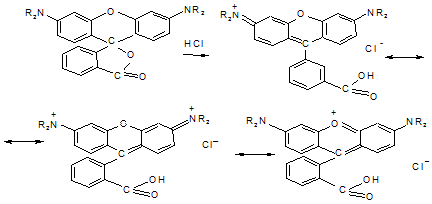 |
 2015-06-10
2015-06-10 1598
1598






