Теория абсолютных скоростей реакций, строго говоря, применима только для рассмотрения реакций в идеальных газах, когда исходные частицы и активированный комплекс можно рассматривать изолированно от окружающей среды.
В растворе образование активированного комплекса из исходных частиц сопровождается теми или иными изменениями молекулярных взаимодействий реагирующих частиц с молекулами растворителя.
Жидкое состояние вещества является промежуточным между твердым и газообразным. Отличаясь от газа и твердого тела, жидкость имеет черты сходства с каждым из этих состояний.
Применение теории активированного комплекса
к кинетике реакций в растворах
Для применения этой теории к жидкости необходимо учесть межмолекулярные взаимодействия исходных частиц и активированного комплекса с молекулами окружающей среды.
Рассмотрим уравнение переходного состояния:
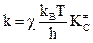 .
.
Раствор нельзя считать идеальным, так как имеется межмолекулярное взаимодействие, поэтому необходимо вместо Kc ввести Ka:
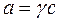 ;
;
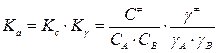 ,
,
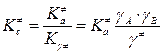 ,
,
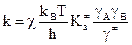 .
.
При g = 1 система идеальная.
Если перейти к изобарному потенциалу, то
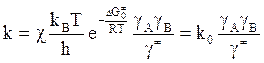 ,
,
где 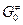 – изобарный потенциал при активности, равной единице.
– изобарный потенциал при активности, равной единице.
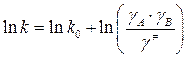 ,
,
k 0 – константа скорости в среде, для которой коэффициенты активности исходных частиц и активированного комплекса приняты равными единице.
Это соотношение называется уравнением Бренстеда-Бьеррума. Данное уравнение в принципе решает вопрос о влиянии среды на скорость элементарной химической реакции, сводя задачу к определению коэффициента активности исходных веществ и активированного комплекса. Однако в то время как существует ряд методов, позволяющих измерить коэффициент активности исходных веществ, величину g ¹ не удается экспериментально измерить из независимых данных. Поэтому уравнение Бренстеда-Бьеррума имеет лишь теоретическое значение.
 2015-06-14
2015-06-14 1687
1687







