Для выявления сущности процессов, происходящих при реакциях обмена, кроме молекулярных, составляют ионные уравнения реакций. В этих уравнениях учитывают характер диссоциации и растворимость реагентов.
· При составлении ионных уравнений в виде ионов записывают только растворимые сильные электролиты. Все остальные вещества (неэлектролиты, слабые или малорастворимые электролиты) записывают в молекулярной форме, так как они образуют в растворе мало ионов.
· Пример. Реакция нейтрализации щелочью NaOH ортофосфорной кислоты H3PO4:
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
Перед составлением ионного уравнения оценим электролитические свойства и растворимость веществ:
H3PO4 – слабый электролит (кислота) - записывают в
молекулярной форме;
NaOH – растворимый сильный электролит (щелочь) –
записывают в виде ионов;
Na3PO4 - растворимый сильный электролит (соль) –
записывают в виде ионов;
H2O - слабый электролит - записывают в молекулярной форме.
Ионное уравнение имеет вид:
H3PO4 + 3Na+ + 3OH- = 3Na+ + PO43- + 3H2O,
после алгебраических преобразований (приведения подобных):
H3PO4 + 3OH- = PO43- + 3H2O.
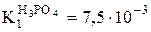
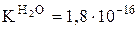
Реакции обмена проходят в направлении большей степени связывания ионов (если образуются слабые электролиты, малорастворимые вещества или газы). Рассмотренное уравнение содержит два слабых электролита, слева и справа, но вода – более слабый электролит, чем ортофосфорная кислота, поэтому реакция преимущественно идет слева направо.
 2015-06-14
2015-06-14 407
407







