Цель работы:
1.Выяснить, как добавление небольшого количества сильной кислоты или основания влияет на рН буферного раствора.
2.Выяснить, является ли физиологический раствор (физраствор) буферным раствором.
Ход работы:
В пробирках №1 и №2 приготовить буферный раствор с соотношением концентраций CH3COONa и CH3COOH равным 2:3 соответственно. Для этого в каждую пробирку отмеривают из бюреток по 4 мл CH3COONa и по 6 мл CH3COOH.
В пробирки №3 и №4 отмеривают мерной пробиркой по 10 мл физиологического раствора (0,9%-ный раствор хлорида натрия).
Для продолжения опыта взять одну пробирку с буферным раствором и другую пробирку – с физраствором.
Пробирки №1 и №3:
-добавить по 5 капель индикатора метиловый оранжевый, окраску полученного раствора записать в таблицу 3;
-если растворы в пробирках отличаются по цвету, то в физиологический раствор (пробирка №3) добавить по каплям разбавленный (0,01н) раствор HCl до выравнивания цвета с раствором в пробирке №1;
- в обе пробирки добавить по 5 капель 0,1Н HCl. Окраски растворов внести в таблицу 3.
Пробирки №2 и №4:
-добавить по 5 капель индикатора метиловый красный, окраску полученного раствора записать в таблицу 3;
-если растворы в пробирках отличаются по цвету, то в физиологический раствор (пробирка №4) добавить по каплям разбавленный (0,01н) раствор HCl до выравнивания цвета с раствором в пробирке №2;
- в обе пробирки добавить по 5 капель 0,1Н NaOH. Окраски растворов внести в таблицу 3.
Таблица1. Влияние добавления небольших количеств сильных кислот и оснований.
| № про-бирки | Объект изучения | Окраска раствора после добавления индикатора | Окраска раствора после добавле-ния HCL0,01 моль/л | Окраска раствора после добавле-ния 5 капель HCL 0,1 моль/л | Окраска раствора после добавле-ния 5 капель NaOH 0,1 моль/л | |
| Метил-оранж | Метил- красный | |||||
| Буферный раствор | _________ | ________ | ________ | |||
| Буферный раствор | _________ | ________ | ________ | |||
| Физиологический раствор | _________ | ________ | ||||
| Физиологический раствор | _________ | ________ |
Примечание: в ячейках таблицы с прочерками записи не делать.
В выводе написать молекулярные и ионно-молекулярные уравнения протекающих реакций (механизм буферного действия). Ответить на вопрос: обладает ли физраствор буферным действием?
Иллюстрация к опыту.

КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Что такое ионное произведение воды?
2. Что означают понятия: нейтральная, кислая, щелочная среда? Каково
значение рН в этих средах?
3. Каково значение рН воды при температурах 273, 323, 353 и 373К?
4.Какая зависимость существует между зарядом и размерами катиона и его способностью к гидролизу?
5.Какая существует взаимосвязь между склонностью катиона к
гидролизу и способностью его гидроксида к основной ионизации
(сила основания)?
6.Какая зависимость существует между зарядом и размером аниона и его склонностью к гидролизу?
7.Какая существует взаимосвязь между склонностью аниона к гидролизу и способностью образованной им кислота к кислотной ионизации (сила кислоты)?
8. Вычислить рН 0,05М НСl и 0,05М СН3С00Н.
9. В 200мл раствора едкого натра содержится 0,2г NaOH. Вычислите
рН этого раствора.
10. Определите концентрации Н+ и ОH- в некотором растворе, если его
рН 4,7.
11. Рассчитайте рН 0,01H Н2СО3 (Диссоциацией по второй ступени
можно пренебречь).
12. Какие из солей Na2CО3, FeCl3, Na2SО4, CuSО4 при растворении в
воде создают кислую реакцию среды?
13. Какое значение рН (больше или меньше 7) имеют растворы солей:
NiSО4, Al2(SO4)3 и K2CО3 ?
14. Какое значение рН (больше или меньше 7) имеют растворы солей:
Na3PO4, K2CO3, FeCI3?
15. Составьте ионные и молекулярные уравнения гидролиза солей CH3COOK, ZnCI2, KCN.
Приложение
Таблица 1
Зависимость между pH и окраской различных индикаторов.
| pH | ≤ 3.1 | ≥ 4.4 | |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| pH | ≤ 8,2 | ≥ 10,0 | |
| Фенолфталеин | Бесцветный | Розовый | Малиновый |
Таблица 2
Константы диссоциации слабых электролитов(25 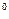 С)
С)
| Название электролита | Формула | Константа диссоциации |
| Азотистая кислота | 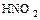 | 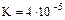 |
| Сернистая кислота | 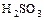 | 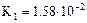 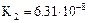 |
| Сероводородная кислота | 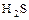 | 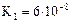 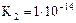 |
| Угольная кислота | 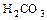 | 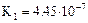 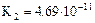 |
| Уксусная кислота | 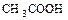 | 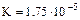 |
| Фосфорная кислота | 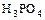 | 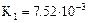 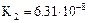 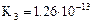 |
| Гидроксид аммония | 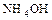 | 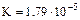 |
| Гидроксид цинка | 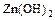 | 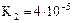 |
| Гидроксидмагния | Mg(OH)2 | 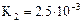 |
| Щавелевая кислота | 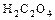 | 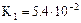 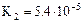 |
- Харин А.Н, Катаева Н.А, Харина А.Т, Курс химии. М.:Высш. Шк., 1973
- Глинка Н.Л Общая химия. Л.:Химия, 1983
- Глинка Н.Л Задачи и упражнения по общей химии. М.:Высш. Шк., 1985
- Ахметов Н.С, Азизова М.К, Бадыгина Л.И Лабораторные и семинарские занятия по неорганической химии. М.:Высш. Шк., 1979
5. Водородный показатель. МУ Автор – составитель С.М. Алейкина, Новгород, НПИ, 1990.
Оглавление
Введение
- Цель работы…………………………………………………………..3
- Основные теоретические положения……………………………….3
2.1 Водородный показатель. Ионное произведение воды……......3
2.2 Вычисление pH растворов кислот и оснований……………….4
2.3 Реакция в растворах солей. Гидролиз………………………….5
2.4 Вычисление pH растворов солей……………………………….6
2.5 Методы определения величины pH. Индикаторы……………..7
- Техника безопасности………………………………………………..7
- Экспериментальная часть……………………………………………8
- Оформление отчёта о работе………………………………………. 10
- Контрольные вопросы и задания…………………………………...10
Приложение…………………………………………………………..12
Библиографический список…………………………………………12
 2015-06-14
2015-06-14 2775
2775