В качестве примера возьмем гидролиз ацетата натрия:
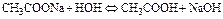
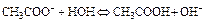
Константа равновесия этой реакции
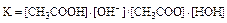 , так как концентрация воды практически остается постоянной, ее можно объединить с константой равновесия:
, так как концентрация воды практически остается постоянной, ее можно объединить с константой равновесия:
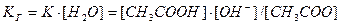
где Кг - константа гидролиза.
Выразим 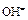 через ионное произведение воды [
через ионное произведение воды [ 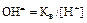 и
и
подставив эту величину в уравнение Кг получаем
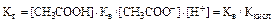
где 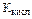 - константа диссоциации слабой кислоты.
- константа диссоциации слабой кислоты.
В общем случае, если исходную концентрацию аниона слабой кислоты А 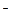 обозначить через С моль/л, то Ch моль/л – это концентрация той части аниона А
обозначить через С моль/л, то Ch моль/л – это концентрация той части аниона А 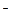 , которая подверглась гидролизу и образовала Ch моль/л слабой кислоты HA и Ch моль/л гидроксильных ионов:
, которая подверглась гидролизу и образовала Ch моль/л слабой кислоты HA и Ch моль/л гидроксильных ионов:
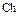
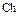
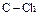
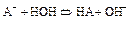
где: h – степень гидролиза, т.е доля молекул соли, подвергающихся гидролизу.
Константа гидролиза соли:
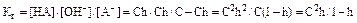
При малом значении h: 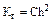 откуда
откуда 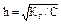 .
.
Так как 
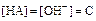 , то
, то 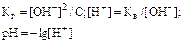
Аналогично соотношение можно получить и при рассмотрении гидролиза соли слабого основания и сильной кислоты:
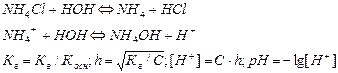
Принимая во внимание, что гидролиз солей, образованных сильными основаниями и многоосновными слабыми кислотами протекает преимущественно по 1-ой ступени:
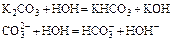
Константа гидролиза определяется уравнением:
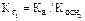
где 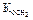 - константа диссоциации слабого основания по 2-ой ступени.
- константа диссоциации слабого основания по 2-ой ступени.
-7-
Пример 4. Определить pH 0.02Н раствора соды Na2C03, учитывая только первую ступень гидролиза.
Решение: Гидролиз соли протекает по уравнению
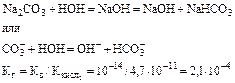
Для вычисления степени гидролиза необходимо вычислить молярную концентрацию раствора 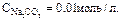
 2015-06-14
2015-06-14 24702
24702








