Разность между температурами кипения раствора Т к и чистого растворителя 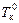 при одном и том же внешнем давлении р вн зависит от моляльной концентрации m растворенного вещества:
при одном и том же внешнем давлении р вн зависит от моляльной концентрации m растворенного вещества:
(1) 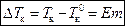 – для разбавленных растворов неэлектролитов,
– для разбавленных растворов неэлектролитов,
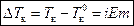 – для разбавленных растворов электролитов,
– для разбавленных растворов электролитов,
где E – эбуллиоскопическая постоянная растворителя; i – изотонический коэффициент, 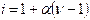 , где α – степень диссоциации электролита; n – число ионов, образующихся при диссоциации одной молекулы.
, где α – степень диссоциации электролита; n – число ионов, образующихся при диссоциации одной молекулы.
Растворы, по сравнению с чистым растворителем, замерзают при более низкой температуре.
Разность между температурами замерзания чистого растворителя 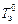 и раствора Т з зависит от моляльной концентрации m растворенного вещества:
и раствора Т з зависит от моляльной концентрации m растворенного вещества:
(2) 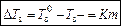 – для разбавленных растворов неэлектролитов,
– для разбавленных растворов неэлектролитов,
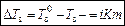 – для разбавленных растворов электролитов,
– для разбавленных растворов электролитов,
где K – криоскопическая постоянная растворителя.
Моляльная концентрация m – число моль растворенного вещества в 1000 г растворителя:
(3) 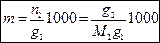 ,
,
где g 1, g 2 – масса (навеска) растворителя и растворенного вещества соответственно, г; n 2, M 2 – число моль и молярная масса (г/моль) растворенного вещества.
Индекс 1 относится к растворителю, индекс 2 – к растворенному веществу.
Пример 3. Температура кипения раствора, содержащего 64 г метанола (М r = 32) в 500 г воды (Е (Н2О) = 0,52 град×кг/моль), равна _____ °С. Варианты ответов: 1) 100; 2) 102,08; 3) 97,92; 4) 104,16.
Метанол не является электролитом, поэтому воспользуемся формулой (1). Моляльная концентрация раствора равна:
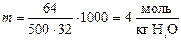
разность между температурами кипения чистого растворителя (воды) и раствора 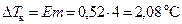 , температура кипения раствора
, температура кипения раствора 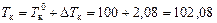 °С.
°С.
Ответ: 102,08 °С.
Пример 4. В 250 г воды растворен неэлектролит с молярной массой 340 г/моль. Раствор замерзает при
-0,28 °С. Криоскопическая постоянная воды К = 1,86 град×кг/моль. Масса вещества в растворе составляет __ г.
Варианты ответов: 1) 12,8; 2) 163,2; 3) 12800; 4) 45,8.
По формуле (2) рассчитаем моляльную концентрацию раствора: 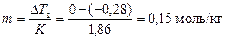 . Зная моляльную концентрацию, можно легко рассчитать массу растворенного вещества (формула (3)):
. Зная моляльную концентрацию, можно легко рассчитать массу растворенного вещества (формула (3)): 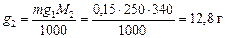
Ответ: 12,8 г.
 2015-06-14
2015-06-14 4636
4636
