Осмос – самопроизвольный переход растворителя из раствора меньшей концентрации в раствор большей концентрации через полупроницаемую мембрану.
Проникновение растворителя в раствор и разбавление раствора можно предотвратить, если к нему приложить дополнительное давление.
Давление, которое необходимо приложить к раствору для предотвращения осмоса и приведения системы в равновесие, называется осмотическим давлением.
Осмотическое давление π (Па) рассчитывают по формуле:
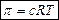 для разбавленных растворов неэлектролитов,
для разбавленных растворов неэлектролитов,
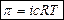 для разбавленных растворов электролитов,
для разбавленных растворов электролитов,
где с – концентрация растворенного вещества, моль/м3; R – универсальная газовая постоянная,
R = 8,314 Дж/(моль×К); Т – температура, К.
При подстановке в формулу молярной концентрации (в моль/дм3) осмотическое давление имеет размерность – кПа.
Концентрация с (моль/дм3) связана с массовой долей w (%) растворенного вещества соотношением:
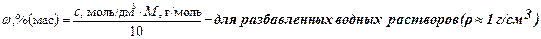
Пример 5. Осмотическое давление крови человека составляет 790 кПа. Массовая доля хлорида натрия в растворе, имеющем такое же осмотическое давление при a=1, равна _____ %.
Варианты ответов: 1) 0,9; 2) 0,1; 3) 0,2; 4) 9.
NaCl – электролит, дающий при диссоциации 2 иона; изотонический коэффициент равен: i = 1+1×(2-1) =2.
Концентрация NaCl в растворе составит:
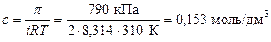 .
.
(310 К – температура тела человека);
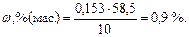
Ответ: 0,9 %.
 2015-06-14
2015-06-14 14385
14385