Термодинамика смачивания. Адгезия жидкости к поверхности твердого тела Wa оценивается работой, которую необходимо затратить для отрыва жидкости' от единицы твердой поверхности.
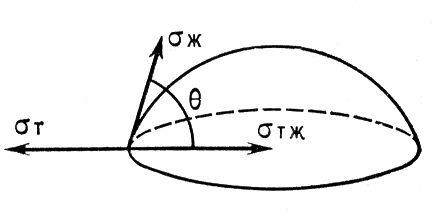
соs θ=(σт-г — σт-ж)/ σж-г
где σ — поверхностное натяжение на соответствующей границе раздела.
Количественно смачиваемость характеризуют равновесным углом смачивания θ на границе раздела трех фаз. Твердое тело лиофильно, т. е. смачивается жидкостью, если 0°<θ<90°, и лиофобно, т. е. не смачивается, если 90°<θ<С 180°. Угол q отсчитывают со стороны жидкости. При статическом (равновесном) смачивание он связан с поверхностным натяжением жидкости (sж), поверхностным натяжением твёрдого тела (sт) и межфазным натяжением на границе твёрдое тело — жидкость (sтж)
Уравнением Юнга: cosq = (sт — sтж)/ sж.
Величиной угла q оценивают лиофильность илиофобность поверхностей по отношению к различным жидкостям. На лиофильной поверхности жидкость растекается, т. е. имеет место частичное (0° <q< 90°) или полное Смачивание (q® 0°); на лиофобной — растекания не происходит (q>90°). Краевой угол зависит от соотношения сил сцепления молекул жидкости с молекулами или атомами смачиваемого тела (адгезия) и сил сцепления молекул жидкости между собой (когезия).
Адгезия – прилипание (сцепление поверхностей) разнородных тел. Когезия – явление сцепления поверхностей разнородных тел, обусловленной межмолекулярным или химическим взаимодействием.
Работа адгезии равна:
Wa = σж-г+ σт-г- σж-г
Из этих двух уравнений получено выражение работы адгезии Дюпре — Юнга, в котором отсутствуют трудно определяемые величины σ -г-г И σ т-ж-
Wa = σж-г(1+cos θ).
При полном смачивании (θ = 0) Wa = 2σж-г, при отсутствии смачивания (θ =180°) Wa = 0.
Работу когезии вычисляют по уравнению:
Wk= 2sж.
При Wa<WK всегда q>0°, причём с увеличением отношения Wa<Wk улучшается смачивание.
Смачивание и растекание жидкости по твердой поверхности может происходить только в том случае, когда работа адгезии больше межмолекулярного взаимодействия в самой жидкости, т. е. работы когезии. При растекании жидкости происходит замена поверхности раздела твердое тело — газ на жидкость — газ с образованием прослойки твердое тело — жидкость.
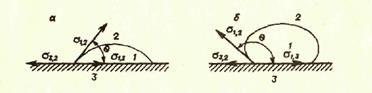
Рис. Смачивание жидкостью поверхности твердого тела:
а — жидкость смачивает твердое тело, 0°< θ <90°; б —жидкость не смачивает твердого тела,
90°< θ < 180°; 1 — жидкость; 2 — газ (пар); 3 — твердое тело.
Общая поверхностная энергия системы при этом уменьшается на величину ∆U = σж-г — σ т-г или ∆U = -σж-гсоs 0 θ, которая является движущей силой смачивания. В случае отрицательного значения ∆U происходит самопроизвольное и полное смачивание с выделением тепловой энергии. При положительном значении ∆U смачивание возможно только при подводе энергии извне, т. е. при нагревании или механическом трении.
Возможность смачивания определяется прежде всего химической природой жидкости и твердого тела, а также запасом поверхностной энергии. Жидкости с малым запасом поверхностной энергии — низким поверхностным натяжением хорошо смачивают поверхности с высокой энергией. Для органических жидкостей способность смачивать поверхность ограничивается так называемым критическим поверхностным натяжением σкр, т. е. максимальным поверхностным натяжением, при котором еще возможно смачивание данного пигмента (рис. 1.14). По значению σкр косвенно можно оценивать поверхностную энергию пигментов и ее изменения при модифицировании поверхности.
Кинетика смачивания. Процесс растекания жидкости проходит с значительными задержками и может останавливаться задолго до достижения равновесного краевого угла смачивания θ. Задержку продвижения границы жидкости на твердой поверхности называют гистерезисом смачивания. Различают три вида гистерезиса. Кинетический гистерезис обусловлен затратой времени на изменение ориентации молекул жидкости, мигрирующей по твердой поверхности. Особенно сильно он проявляется в высокоструктурированных пленкообразующих веществах. Порядковый или статический гистерезис обусловлен затратой энергии и времени на вытеснение находящихся всегда на твердой поверхности адсорбированных газов и паров жидкостей. Дисперсионный гистерезис обусловлен затратой времени на преодоление неровностей поверхности. Он особенно сильно проявляется при смачивании порошков пигментов и возрастает с увеличением их дисперсности. Краевой угол θ при смачивании порошков может быть намного больше, чем при смачивании того же материала с гладкой поверхностью (в монолите).
Частицы пигментов всегда агрегированы, и чем они меньше, тем прочнее контакты и меньше капиллярные каналы между ними и тем труднее проникать в них смачивающей жидкости. Скорость пропитки порошков жидкостью uпр описывается уравнением Уошберна:
uпр = 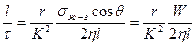
где l — длина пути пройденного жидкостью в слое порошка за время т; r — средний радиус капилляров порового пространства между частицами; K—коэффициент, характеризующий упаковку частиц, их форму и извилистость каналов; σж-г — поверхностное натяжение смачивающего раствора; θ — равновесный краевой угол смачивания; η — вязкость жидкости; W — энергия смачивания — движущая сила процесса пропитки порошка жидкостью.
Из уравнения следует, что скорость пропитки порошка, имеющего постоянное значение K, тем больше, чем выше σж-гсоs θ и W и чем ниже η и 0 θ. Соs θ имеет максимальное значение (.соs θ = 1) при θ = 0. Наибольшее приближение к этому значению дают жидкости с наименьшим поверхностным натяжением σж-г- Но, согласно уравнению, чем выше σж_г, тем больше скорость пропитки порошка uпр. Поэтому на практике необходимо подбирать оптимальные значения вязкости смачивающей жидкости η, ее поверхностного натяжения σж-г и равновесного краевого угла смачивания θ, зависящего от свойств, как твердой поверхности, так и жидкости.
 2015-06-14
2015-06-14 4207
4207
