В тех случаях, когда измерить площадь поверхности трудно, количество i-гo компонента (или его массу 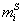 ) относят к массе адсорбента m, используя величину удельной адсорбции
) относят к массе адсорбента m, используя величину удельной адсорбции 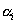 :
:
Если 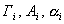 > 0, адсорбцию называют положительной (в дальнейшем термином "адсорбция" будем называть именно положительную адсорбцию), если < 0, то имеет место отрицательная адсорбция.
> 0, адсорбцию называют положительной (в дальнейшем термином "адсорбция" будем называть именно положительную адсорбцию), если < 0, то имеет место отрицательная адсорбция.
Экспериментальные изотермы адсорбции являются наиболее распространенным способом описания адсорбционных явлений. Методы получения адсорбционных данных для построения изотерм адсорбции основаны на измерении количества газа (жидкости), удаленного из газовой (жидкой) фазы при адсорбции, а также на различных способах определения количества адсорбата (адсорбированное вещество) на поверхности адсорбента (адсорбирующее вещество), например, волюметрический метод, гравиметрический метод и др.
Адсорбция зависит от концентрации компонентов и температуры.
Г = f(c,T) - жидкость;
Г = f(P,T) - газ
Различают следующие виды зависимостей:
| Изотерма | Изобара | Изостера |
| Г=fT(c) | Г=fP(T) | Г=fA(T) |
| Г=fT(P) | Г=fC(T) | Г=fA(T) |
Для определения количества адсорбирующего вещества могут применяться следующие уравнения:
1) Уравнение Гиббса, устанавливающее соотношение межу величиной адсорбции Г (кмоль/м2), концентрацией раствора с (кмоль/м3) и мерой поверхностной активности (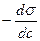 ):
):
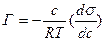 ,
, 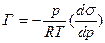
для жидкостей для газов
R – универсальная газовая постоянная,
Т – температура, К
В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной 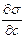 . Эта производная определяет и знак гиббсовской адсорбции, и может служить характеристикой вещества при адсорбции. Чтобы исключить влияние концентрации на производную берут ее предельные значения, т.е. при стремлении концентрации к нулю. Эту величину Ребиндер назвал поверхностной активностью.
. Эта производная определяет и знак гиббсовской адсорбции, и может служить характеристикой вещества при адсорбции. Чтобы исключить влияние концентрации на производную берут ее предельные значения, т.е. при стремлении концентрации к нулю. Эту величину Ребиндер назвал поверхностной активностью.
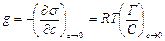 ;
;
g = [Дж×м/моль] = [Н×м2/моль]; [эрг см/моль] = [Гиббс].
Уравнение показывает, что чем сильнее снижается 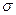 = f(c) с увеличением концентрации, тем больше поверхностная активность этого вещества.
= f(c) с увеличением концентрации, тем больше поверхностная активность этого вещества.
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции
2) Уравнение монослойной адсорбции Ленгмюра:
Теория мономолекулярной адсорбции Ленгмюра основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
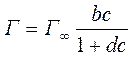
Г – величина адсорбции (кмоль/м2);
Г∞ - предельное количество адсорбирующего вещества (кмоль/м2),
b – константа, характеризующая поверхностную активность вещества (ее значение то же, что в уравнении Шишковского),
с – равновесная концентрация растворенного вещества (кмоль/м3).
Константы Г∞ и b можно найти графически, преобразовав уравнение Ленгмюра в уравнение прямой:
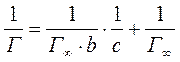
Используя уравнение Шишковского, можно перейти от уравнения Гиббса к уравнению Ленгмюра. Для этого достаточно продифференцироватьуравнение Шишковского:
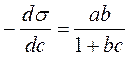
и подставить выражение производной в уравнение Гиббса:
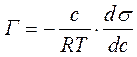
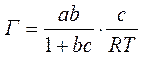
Или 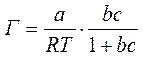
Очевидно, 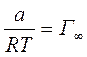 , и тогда
, и тогда 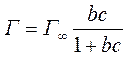
3) при адсорбции газа или растворенного вещества на твердом адсорбенте используют эмпирическое уравнение Фрейндлиха:
Теоретические представления, развитые Ленгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
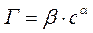 (для растворов)
(для растворов) 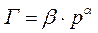 (для газов)
(для газов)
Уравнение Фрейндлиха хорошо согласуется с экспериментальными данными адсорбции в области средних концентраций. Чтобы вычислить константы β и α достаточно прологарифмировать уравнение и построить прямую в координатах lg Г = f (lg c);
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, (отсекающей на оси ординат отрезок, равный lg Г), тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (tgα=β).
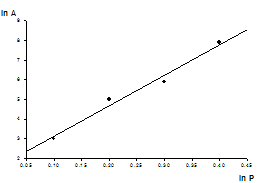
Изотерма адсорбции в координатах логарифмического уравнения.
4) уравнение для расчета полислойной адсорбции разработано М. М. Дубининым. Изотерма адсорбции на адсорбентах с мелкими порами (средний радиус порядка 10-9м) - они получили название адсорбентов I структурного типа - имеет вид:
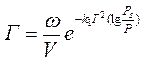
А для крупнопористых адсорбентов II структурного типа (средний радиус порядка 10-7-10-6 м):
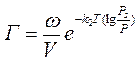
Где Г – величина адсорбции (кмоль/кг),
ω – общая пористость (м3/кг),
V- молярный объем адсорбируемого вещества в жидком состоянии (м3/кмоль),
Т – температура (К),
k1 и k2 – константы,
р – равновесное давление пара при данной темературе (н/м2),
рs – давление насыщенного пара (н/м2)
При логарифмировании уравнение переходит в линейную форму, откуда графически легко определяется пористость сорбентов. Для построения кривых распределения пор сорбентов по радиусам применяют метод капиллярной конденсации, заключающийся в следующем. Экспериментально определяют величину адсорбции в зависимости от увеличения равновесного давления, а затем определяют величину десорбции при снижении равновесного давления. На графике в координатах
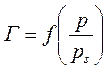
Кривые адсорбции и десорбции не совпадают — образуется петля гистерезиса. Истинному ходу процесса сорбции отвечает ветвь десорбции; ее и используют для расчета пористости ω (м3/кг):
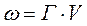 ,
,
где Г - экспериментально определенная величина сорбции (кмоль/кг);
V -молярный объем вещества (по справочнику) (м3/моль).
Для определения радиусов пор применяют уравнение Томсона:
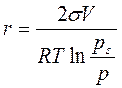 ,
,
где σ - поверхностное натяжение конденсата при данной температуре (дж/м2) (по справочнику);
V – молярный объём конденсата (м3/кмоль) (по справочнику);
R - газовая постоянная; рs - давление насыщенного пара над макроповерхностью (н/м2) (по справочнику);
р - равновесное давление в капилляре данного радиуса (н/м2) (из графика - по кривой десорбции);
Т -температура (К).
Интегральная кривая строится в координатах ω = f (r), а дифференциальная - в координатах 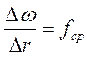
Где 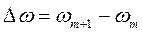 ,
, 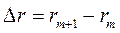 ,
,
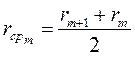 ,
,
 2015-06-14
2015-06-14 9241
9241
