Пигменты, в состав которых входят металлы в разных валентных состояниях, всегда интенсивно окрашены. К таким пигментам относятся свинцовый сурик Pb3O4, являющийся свинцовой солью ортосвинцовой кислоты, черный железооксидный пигмент Fe3O4, кристаллическая решетка которого представляет собой кубическую плотную упаковку ионов кислорода, в пустотах которой распределены ионы Fe 2+ и Fe 3+, железная лазурь KxFey[Fe(CN)6]z.nH2O, которая образует кубическую решетку с ионом K+ в центре, ионы Fe2+ окружены атомами углерода, а ионы Fe3+ - атомами азота. Окраска всех этих соединений обусловлена переходом электрона с иона более низкой валентности на ион более высокой валентности.
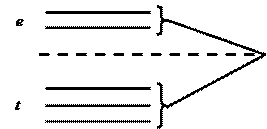
В кристалле черного железооксидного пигмента ион Fe2+ находится в октаэдрическом окружении ионов кислорода и имеет конфигурацию внешнего электронного слоя 3s23p63d5. Согласно теории кристаллического поля, основное состояние с пятью d – электронами не расщепляется. Таким образом, в соединении, где имеются ионы Fe 2+ и Fe 3+, есть нерасщепленный уровень, который по энергетическому состоянию располагается между двумя уровнями, получающимися в результате расщепления основного состояния иона Fe 2+ (рисунок).
|
|
|
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
Рисунок – Соотношение энергетических состояний уровней, получившихся при расщеплении d - орбиталей в октаэдрическом кристаллическом поле
В этом случае возможен переход электрона не только с уровня t на уровень е, но и на уровень, соответствующий основному состоянию иона Fe3+. Это сильно расширяет полосу поглощения в области видимого света.
В железной лазури ионы Fe 2+ и Fe 3+ находятся в октаэдрическом поле лигандов (углерода и азота, соответственно). Интенсивная синяя окраска этого соединения обусловлена переходом электрона с иона Fe2+ на ион Fe3+.
 2015-06-14
2015-06-14 498
498








