Большинство веществ обладают малой растворимостью в воде и других растворителях. В насыщенном растворе малорастворимого электролита устанавливается гетерогенное равновесие между твердой фазой и ионами, образующимися при частичном растворении осадка.
Так, в насыщенном растворе электролита АnBm, находящегося в равновесии с его твердой фазой, будет протекать следующий обратимый процесс:
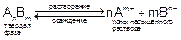
Этот процесс протекает на поверхности осадка. Состояние этого равновесия по закону действующих масс количественно характеризуется константой, называемой произведением растворимости (ПР):
ПР (AnBm)=[Am+]n[Bn–]m
В насыщенном растворе малорастворимого электролита произведение молярных концентраций ионов, возведенных в степени, равны их стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимости.
ПР зависит от природы растворителя и растворенного вещества, от температуры и не зависит от концентрации ионов в растворе.
Пример. Са3(РО4)2 «3Са2+ + 2РО43–
ПР=[Са2+]3[РО43–]2
Произведение растворимости и растворимость вещества являются характеристиками малорастворимого вещества, между этими величинами существует тесная связь.
Растворимость (S) – это максимально возможная концентрация вещества в растворе, выражается в г/л, г/100 г Н2О.
Молярная растворимость S совпадает с молярной концентрацией насыщенного раствора, выражается в моль/л и связана с ПР:
ПР(AnBm)=[Am+]n[Bn–]m=(nS)n•(mS)m.
Для двухионных электролитов, например AgCl(n=1,m=1):
ПР(AgCl)=[Ag+][Cl–]=S2(AgCl)
Для трехионных электролитов, например CaF2(n=1,m=2):
ПР(CaF2)=[Ca2+][F]2=S(2S)2=4S3.
Следовательно, произведение растворимости и растворимость – взаимосвязанные величины, поэтому по известной растворимости вещества можно найти значение произведения растворимости и наоборот.
Вычисление произведения растворимости
малорастворимого электролита
При расчете произведения растворимости необходимо перевести в молярную растворимость (моль/л) растворимость, выраженную в г/л или г/100 г Н2О.
Для перехода растворимости, выраженной в г/100 г Н2О, к молярной концентрации можно принять объем насыщенного раствора»100 мл, учитывая малую растворимость электролита в Н2О.
Пример. Растворимость Mg(OH)2 при 18°С равна 0,012 г/л. Вычислите ПР(Mg(OH)2).
Молярная масса Mg(OH)2: М(Mg(OH)2)=58 г/моль. Рассчитаем молярную растворимость Mg(OH)2
S(Mg(OH)2) = L: M(Mg(OH)2) = 0,012: 58 = 2,07•10–4 моль/л
Молярная растворимость совпадает с молярной концентрацией соли в растворе:
С(Mg(OH)2) = S(Mg(OH)2) = 2,07•10–4 моль/л
Найдем равновесные молярные концентрации ионов в растворе:
Mg(OH)2 «Mg2+ + 2OH–
[Mg2+] = S =2,07•10–4 моль/л
[ОН–] = 2S = 2,07•10–4•2 = 4,14•10–4 моль/л
Тогда ПР(Mg(OH)2) = [Mg2+][OH–]2;
ПР(Mg(OH)2) = 2,07•10–4•(4,14•10–4)2 = 3,5•10–11
Вычисление концентрации ионов и растворимости
малорастворимого электролита в его насыщенном
растворе
Пример. Произведение растворимости PbJ2 при 18°С равно 1,4•10–8. Рассчитайте концентрации ионов Pb2+ и J– и молярную растворимость
PbJ2 «Pb2+ + 2J–
ПР(PbJ2) = [Pb2+][J–]2
Обозначим молярную растворимость соли – S моль/л. Тогда концентрации ионов равны:
[Pb2+] = S [J–] = 2S
Следовательно
ПР(PbJ2) = [Pb2+][J–]2
ПР(PbJ2) = S(2S)2 = 4S3
1,4•10–8 = 4S3
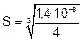 ; S = 1,5•10–3 моль/л
; S = 1,5•10–3 моль/л
Молярная растворимость соли равна 1,5•10–3 моль/л.
Концентрации ионов равны:
[Pb2+] = 1,5•10–3 моль/л
[J–] = 2•1,5•10–3 = 3,0•10–3 моль/л.
Чтобы от молярной растворимости перейти к растворимости в г/л, необходимо молярную растворимость умножить на молярную массу вещества.
L = S•M(PbJ2) = 1,5•10–3•461 = 0,692 г/л.
 2015-06-04
2015-06-04 3116
3116
