При проведении реакций в растворе, в результате которых возможно образование осадка, необходимо соблюдать определенные требования к выбору концентраций реагентов.
Условие образования осадка: произведение молярных концентраций ионов, возведенных в степень стехиометрических коэффициентов (ПК), должно быть больше величины произведения растворимости (ПР):
AnBm «nAm+ + mBn–
ПК(AnBm) = (CA+m)n•(CB–n)m > ПР(AnBm)
Если ПК(AnBm) < ПР(AnBm), то осадок не образуется. Следовательно, зная концентрации ионов малорастворимого электролита в растворе, можно ориентировочно оценить, выпадет ли в данном случае осадок.
Пример. Произведение растворимости Fe(OH)2 при 25°С равно 1,65•10–15. Выпадет ли осадок при смешивании 4 мл 0,04н. FeSO4 и 6 мл 0,01М NaOH?
Решение. Молекулярное уравнение реакции
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Ионно-молекулярное уравнение реакции
Fe2+ + 2OH– = Fe(OH)2
Для определения условия образования осадка необходимо рассчитать ПК
ПК(Fe(OH)2) = [Fe2+][OH–]2
Для нахождения ПК нужно найти концентрации Fe2+ и ОН– после смешивания растворов заданной концентрации. Определяем исходные концентрации ионов до сливания растворов:
NaOH «Na+ + OH– [ОН–]=0,01 моль/л
0,01 моль/л 0,01 моль/л
Для определения концентрации ионов Fe2+ нужно перевести нормальную концентрацию FeSO4 в молярную.
fэк(FeSO4) = 1/2 0,04н FeSO4 = 0,02M FeSO4
FeSO4 «Fe2+ + SO42–
0,02 моль/л 0,02 моль/л
Определяем концентрацию ионов после смешивания растворов.
Объем раствора после смешивания 4 мл FeSO4 и 6 мл NaOH стал 10 мл.
Концентрация ионов после смешивания растворов
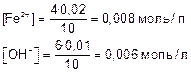
Находим произведение концентраций
ПК(Fe(OH)2) = [Fe2+][OH–]2
ПК(Fe(OH)2) = 0,008 • 0,0062 = 2,88•10–7
Сравниваем ПК с ПР (приложение, табл.3)
2,88•10–7 > 1,65•10–15
Следовательно при сливании 4 мл 0,004н. раствора FeSO4 и 6 мл 0,01М раствора NaOH образуется осадок Fe(OH)2.
Исходные данные и результаты расчета заносим в таблицу.
| Ионы | Концентрация, моль/л | ПК = [Fe2+][OH–]2 | |
| до сливания растворов | после сливания растворов | ||
| [Fe2+] | 0,02 | 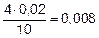 | ПК = 0,008 • 0,0062 = = 2,88•10–7 2,88•10–7 > 1,65•10–15 |
| [OH–]2 | 0,01 | 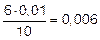 |
6. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.
СТРОЕНИЕ АТОМА
С точки зрения квантовой механики состояние электрона в атоме можно представить в виде электронного облака определенной формы, которое называют атомной орбиталью (АО). Размеры, форма и расположение АО в пространстве вокруг ядра атома определяются четырьмя квантовыми числами.
Главное квантовое число (n) определяет энергию электрона – его энергетический уровень. Оно принимает значения
n=1, 2, 3, 4…. Чем больше n, тем выше энергия электрона, тем дальше находится он от ядра атома.
Орбитальное квантовое число (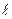 ) определяет форму атомной орбитали.
) определяет форму атомной орбитали.
Энергетический уровень расщеплен на подуровни, поэтому орбитальное квантовое число характеризует данный подуровень. Орбитальные квантовые числа принимают значения от 0 до (n-1). Обычно подуровни обозначаются буквами.
Орбитальное
квантовое число (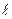 ) 0 1 2 3
) 0 1 2 3
Энергетический
подуровень s p d f
 Магнитное квантовое число (m) характеризует ориентацию орбитали в пространстве. Оно принимает значения от -
Магнитное квантовое число (m) характеризует ориентацию орбитали в пространстве. Оно принимает значения от - 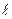 …0…+
…0…+ 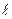 . Например, если
. Например, если 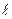 =2, то m имеет значение -2, -1, 0 +1, +2 – пять вариантов ориентации. Условно АО обозначают в виде клетки.
=2, то m имеет значение -2, -1, 0 +1, +2 – пять вариантов ориентации. Условно АО обозначают в виде клетки.
 Для s-подуровня имеется одна АО;
Для s-подуровня имеется одна АО;


 для р-подуровня – три АО;
для р-подуровня – три АО;




 для d-подуровня – пять АО;
для d-подуровня – пять АО;






 для f-подуровня – семь АО.
для f-подуровня – семь АО.
Спиновое квантовое число (ms) характеризует вращение электрона вокруг собственной оси. Спиновое квантовое число имеет только два значения:
+1/2 – вращение по часовой стрелке;
-1/2 – вращение против часовой стрелки.
Графически электрон обозначают вертикальной стрелкой. Электроны с разными спинами – противоположно направленными стрелками ¯.
Распределение электронов по атомным орбиталям происходит в соответствии с определенными закономерностями.
Принцип наименьшей энергии: электроны заполняют орбитали в порядке повышения уровня энергии орбиталей:
Es < Ep < Ed < Ef
Первыми заполняются орбитали с минимальными уровнями энергии.
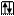 Принцип Паули: в атоме не может быть двух электронов, для которых одинаковы значения всех четырех квантовых чисел. На одной АО может находиться не более двух
Принцип Паули: в атоме не может быть двух электронов, для которых одинаковы значения всех четырех квантовых чисел. На одной АО может находиться не более двух  с противоположными спинами.
с противоположными спинами.
Правило Хунда:  располагаются в атоме так, чтобы суммарный спин был максимальным, т.е. при заполнении орбиталей
располагаются в атоме так, чтобы суммарный спин был максимальным, т.е. при заполнении орбиталей  располагаются по одному, затем орбитали заполняются вторыми
располагаются по одному, затем орбитали заполняются вторыми  с противоположными спинами.
с противоположными спинами.
Правило Клечковского: заполнение подуровней происходит в порядке возрастания суммы квантовых чисел 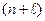 , а при равной сумме
, а при равной сумме 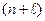 в порядке возрастания числа n.
в порядке возрастания числа n.
1s®2s®2p®3s®3p®4s®3d®4p®5s®4d®5p®6s®4f®5d®
®6p®7s®5f®6d…
Периодическая система химических элементов
Д.И.Менделеева
Строение периодической системы элементов строго соответствует строению атомов химических элементов. Основные закономерности:
1. Порядковый номер элемента равен заряду ядра атома и общему числу  в атоме.
в атоме.
2. Номер периода определяет число энергетических уровней в атоме элемента данного периода, на которых имеются  .
.
3. Номер группы определяет максимально возможное число валентных  . Каждая группа подразделяется на две подгруппы – главную и побочную. Если элемент принадлежит к главной подгруппе, то число
. Каждая группа подразделяется на две подгруппы – главную и побочную. Если элемент принадлежит к главной подгруппе, то число  на внешнем уровне равно номеру группы. Если элемент принадлежит к побочной подгруппе, то число
на внешнем уровне равно номеру группы. Если элемент принадлежит к побочной подгруппе, то число  на внешнем уровне, как правило, равно 2. У некоторых элементов происходит провал
на внешнем уровне, как правило, равно 2. У некоторых элементов происходит провал  с внешнего на предвнешний уровень – Cr, Cu, Ag, Au, Pt и др., т.е. на внешнем уровне находится 1
с внешнего на предвнешний уровень – Cr, Cu, Ag, Au, Pt и др., т.е. на внешнем уровне находится 1  , а другой переходит на предвнешний уровень.
, а другой переходит на предвнешний уровень.
4. Электронное семейство. Все элементы периодической системы принадлежат к четырем электронным семействам s, p, d, f. Это определяется тем, какой подуровень элемента заполняется электронами последним. Любой период начинается с заполнения s-подуровня, поэтому первые два элемента принадлежат к s-семейству. Последние шесть элементов каждого периода принадлежат к р-семейству. В побочных подгруппах находятся d и f-элементы.
Зная порядковый номер элемента, можно написать электронную формулу атома – распределение всех имеющихся в атоме  по энергетическим уровням и орбиталям. Кроме электронной формулы составляют электронно-графические формулы.
по энергетическим уровням и орбиталям. Кроме электронной формулы составляют электронно-графические формулы.
Пример 1. Составить электронную формулу элемента №51. Для электронов внешнего уровня написать электронно-графическую формулу.
Решение. По таблице периодической системы Д.И.Менделеева находим элемент №51 – это сурьма. Атом имеет заряд ядра +51 и на его энергетических уровнях находится 51 электрон.
Период 5, следовательно  распределены на пяти энергетических уровнях.
распределены на пяти энергетических уровнях.
Группа V, значит максимально возможное число валентных  равно пяти.
равно пяти.
Подгруппа главная, следовательно валентные  находятся на внешнем уровне, и сурьма принадлежит к р-семейству.
находятся на внешнем уровне, и сурьма принадлежит к р-семейству.
Электронная формула:
Sb +51 1s22s22p63s23p64s23d104p65s24d105p3
Электронно-графическая формула:
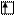
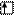
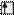
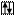 5
5
s p
Пример 2. Строение внешнего и предвнешнего энергетических уровней выражается формулой 3d34s2. Какой это элемент? Написать электронно-графическую формулу для этого состояния.
Решение. Главное квантовое число n=4, это значит, что элемент находится в четвертом периоде. На внешнем и предвнешнем энергетических уровнях находится 5 валентных  , это значит, что элемент находится в пятой группе. Так как у элемента идет заполнение d-подуровня, значит он относится к d-элементам и расположен в побочной подгруппе. Искомый элемент – ванадий.
, это значит, что элемент находится в пятой группе. Так как у элемента идет заполнение d-подуровня, значит он относится к d-элементам и расположен в побочной подгруппе. Искомый элемент – ванадий.


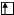
 Электронно-графическая формула: 3 4
Электронно-графическая формула: 3 4
d s
 2015-06-04
2015-06-04 5261
5261








