Цель работы: изучение химических реакций в растворах электролитов.
Реакции, протекающие в растрах электролитов, сводится к взаимодействию ионов растворенных веществ. Реакции в растворах электролитов идут только в случае, если в результате электростатического взаимодействия разноименно заряженных ионов образуются молекулы нового вещества: труднорастворимого, газообразного или малодиссоциированного. Если ни одно из таких веществ при протекании реакции не образуется, то не происходит и самой реакции.
К слабым электролитам относятся не только молекулы слабых кислот и оснований, но и их ионы, образующиеся при диссоциации по первой или второй ступени (например, HCO3-, HPO4-, MgOH+).
Константа диссоциации их, как правило, меньше, чем константа диссоциации соответствующих им кислот и оснований. К слабым электролитам относятся и относительно прочные комплексные ионы.
Если в реакцию вступают слабые электролиты, летучие или малорастворимые вещества, то реакции происходят в тех случаях, когда образующиеся вещества будут менее диссоциироваными, более летучими, менее растворимыми.
Значительно чаще приходится иметь дело с образованием труднорастворимых веществ, которые удаляются из сферы реакции в виде осадка, например:
Ca(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3
или ионное уравнение реакции
Ca2+ + CO32- = CaCO3↓
В насыщенном растворе любой соли с осадком имеет место равновесие:
CaCO3 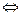 Ca2+ + CO32-
Ca2+ + CO32-
в осадке в растворе
Переход ионов из твердой фазы в жидкую происходит только с поверхности и не зависит от массы твердого вещества. Прилагая сюда закон действия масс, получаем:
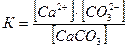
Так как концентрация твердой фазы величина постоянная, то умножив константу равновесия на концентрацию электролита в осадке, мы получаем новую константу
К ∙ [CaCO3] = ПР,
которая оказывается равной произведению концентрации ионов электролитов в растворе
ПР = [Ca2+] [CO32-].
Таким образом, в насыщенном растворе труднорастворимого электролита произведением концентраций ионов является величиной постоянной при данной температуре. Эта величина называется произведением растворимости (ПР).
Чем меньше ПР, тем менее растворимо вещество. Как только произведение концентраций ионов станет больше ПР, вещество выпадет в осадок. При повышении температуры обычно значение ПР увеличивается. Образование и растворение осадков в химических реакциях непосредственно связано со значениями произведения растворимости.
При введении в раствор одноименных ионов равновесие сдвигается в сторону осадка. Это означает, что концентрация ионов второго типа становится меньше. Однако произведение концентраций ионов остается прежним, равным произведению растворимости. Растворение осадка вызывается уменьшением концентрации ионов путем связывания их в молекулы малодиссоциирующих веществ.
 2015-01-07
2015-01-07 305
305







