Процессы электролиза подчиняются законам Фарадея:
Первый закон:
Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита.
Второй закон:
При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам.
Для расчетов используют объединенное уравнение законов Фарадея:
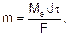
где m – масса электролита, подвергшаяся химическому превращению, или масса вещества, выделившегося на электроде, г; Мэ – молярная масса эквивалентов вещества, г/моль; J – сила тока, А; t - время электролиза, с; F – число Фарадея (96500 Кл/моль).
Молярная масса эквивалентов вещества рассчитывается по формуле:
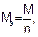
где М – молярная масса вещества, г/моль;
n – число электронов, участвующих в электродном процессе.
Для расчета объемов газообразных продуктов электролиза в законе Фарадея молярная масса эквивалентов вещества Мэ заменяется на молярный объем эквивалента газа при нормальных условиях (Vэ), который рассчитывается по формуле:
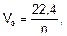
где 22,4 – это объем, который занимает 1 моль любого газа при нормальных условиях, л; n – число  , отданных или принятых 1 моль газа.
, отданных или принятых 1 моль газа.
При проведении электролиза в реальных условиях, вследствие побочных процессов масса вещества, выделившегося на электроде, оказывается меньше массы, рассчитанной по закону Фарадея. Отношение массы вещества, полученной при электролизе (mпракт.) к массе вещества, рассчитанной по закону Фарадея (mтеор.), выраженное в процентах, называется выходом по току (Вт):
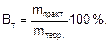
Пример 1. Составьте электронные уравнения электродных процессов, протекающих при электролизе раствора CuSO4. Определите массу меди и объем газа, выделившихся на электродах при прохождении тока силой 5 А в течение 2 часов.
Решение. В водном растворе CuSO4 диссоциирует по схеме
CuSO4 ® Cu2+ + SO42–
При электролизе раствора соли CuSO4 на катоде будут восстанавливаться ионы Cu2+, а на аноде – окисляться молекулы воды.
 Катод (–): Cu2+ + 2
Катод (–): Cu2+ + 2  ® Cu 2
® Cu 2
Анод (+): 2Н2О - 4  ® О2 + 4Н+ 1
® О2 + 4Н+ 1
 |
Суммарная реакция: 2CuSO4 + 2H2O ® 2Cu + O2 + 2H2SO4
Молекулы H2SO4 образуются в результате побочной реакции между ионами Н+ и кислотными остатками SO42–, которые накапливаются у поверхности анода.
Масса меди, выделившейся на катоде:
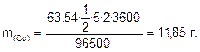
Объем кислорода, выделившегося на аноде:
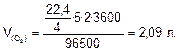
Ответ: m(Сг)=11,85 г; 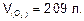
Пример 2. Составьте схему электролиза водного раствора соли NaCl и рассчитайте массу образовавшегося на катоде гидроксида натрия, если на аноде выделилось 1,12 л газа.
Решение. В водном растворе NaCl диссоциирует по схеме:
NaCl ® Na+ + Cl–
При электролизе раствора NaCl на катоде будет восстанавливаться водород из молекул воды, а на аноде – окисляться ионы Cl– до газообразного Cl2:
 Катод (–): 2Н2О + 2
Катод (–): 2Н2О + 2  ® Н2 + 2ОН– 1
® Н2 + 2ОН– 1
Анод (+): 2Cl– - 2  ® Cl2 1
® Cl2 1
 |
Суммарная реакция: 2NaCl + 2H2O ® H2 + 2NaOH + Cl2
Молекулы NaОН образуются в результате взаимодействия ионов ОН– с ионами Na+, которые накапливаются у поверхности катода.
Молярный объем эквивалента хлора:
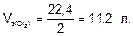
Количество эквивалентов хлора:
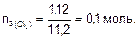
Так как на электродах выделяется одинаковое количество эквивалентов веществ, то
nэ(NaOH) = 0,1 моль.
Масса образовавшегося NaOH:
n(NaOH) = Mэ(NaOH)×nэ(NaOH) = 40 × 0,1 = 4 г.
Ответ: 4 г.
Пример 3. Определите массу цинка, который выделится на катоде при электролизе сульфата цинка в течение 1 часа при токе 26,8 А, если выход цинка по току равен 58%. Составьте схему электродных процессов.
Решение. Согласно закону Фарадея масса выделившегося цинка:
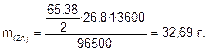
С учетом выхода по току практически выделившаяся масса цинка:
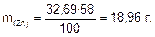
 Схема электролиза раствора ZnSO4:
Схема электролиза раствора ZnSO4:
ZnSO4 ® Zn2+ + SO42–
 Катод (–): Zn2+ + 2
Катод (–): Zn2+ + 2  ® Zn
® Zn 2H2O + 2  ® H2 + 2OH–
® H2 + 2OH–
 Анод (+): 2H2O - 4
Анод (+): 2H2O - 4  ® O2 + 4H+ 1
® O2 + 4H+ 1
Cуммарная реакция:
2ZnSO4 + 4H2O ® Zn + H2 + Zn(OH)2 + O2 + 2H2SO4
Низкий выход по току цинка объясняется тем, что одновременно с цинком на катоде восстанавливаются молекулы воды и часть электричества расходуется на этот процесс.
Ответ: 18,96 г.
 2015-06-04
2015-06-04 8741
8741
