ЛЕКЦИЯ №11
Тема 4.3.2. Производство металлических порошков электролизом
(продолжение)
Электролиз водных растворов
Производство металлических порошков методом электролиза водных растворов с успехом конкурирует с другими известными методами. В настоящее время в промышленных масштабах получают порошки меди, серебра, железа, хрома, цинка, никеля, кадмия, свинца, олова, сурьмы, а также их сплавов.
Характер образующихся катодных осадков зависит как от индивидуальных особенностей металлов, так и от состава электролита и условий электролиза. Некоторые металлы, например никель, цинк или кобальт, образуют равномерные плотные мелкозернистые осадки почти независимо от природы электролита. Другие, например серебро или кадмий, растут в виде отдельных сильно разветвляющихся кристаллов при электролизе растворов простых солей, в то время как из растворов комплексных цианистых солей эти металлы выделяются в виде совершенно ровного гладкого слоя.
Плотные осадки никеля, кобальта, железа, хрома и других металлов получаются, как правило, в тех случаях, когда электролиз ведут при незначительных концентрациях водородных ионов, повышенных содержаниях ионов выделяемого металла и низких плотностях тока. Для придания такому осадку хрупкости используют смазку катода различными веществами или введение в раствор специальных добавок. Получение чешуйчатых осадков состоит в том, что на катод слоями попеременно наносят два металла, один из которых представляет подслой. Затем при обработке соответствующими реагентами подслой переводят в раствор, а второй металл остается в виде отдельных чешуек.
Губчатые мягкие осадки представляют собой скопления отдельных мелких кристалликов, легко поддающихся разрушению растиранием. Получению таких осадков способствуют сравнительно низкие плотности тока, повышение кислотности раствора, уменьшение концентрации в электролите катионов выделяемого металла, наличие примесей ионов более электроположительных металлов и присутствие некоторых окислителей.
Рыхлые или так называемые черные осадки являются высокодисперсными порошками, получающимися в готовом виде непосредственно в процессе электролиза. Их образованию способствуют высокие плотности тока, низкие концентрации в электролите катионов выделяемого металла, повышенная кислотность электролита и наличие некоторых примесей в нем или осаждаемого металла в составе комплексного аниона.
Основные факторы, влияющие на размер частиц, состав и структуру электролитических порошков - плотность тока, температура, кислотность и концентрация водного электролита. Размер частиц и гранулометрический состав порошков определяются в первую очередь (при прочих равных условиях) плотностью тока; при этом, как правило, повышение плотности тока способствует выделению на катоде более дисперсных осадков. Однако это положение не является всеобщим. Например, при электролизе комплексных цианистых растворов, в которых концентрация катионов выделяемого металла ничтожно мала, следовало бы ожидать образования порошкообразных осадков; на самом же деле из цианистых растворов порошкообразные осадки не получаются даже при очень высоких плотностях тока и при одновременном выделении водорода вместе с осаждаемым металлом.
Для установления математической зависимости между плотностью тока, временем наращивания осадка и концентрацией катионов в электролите О.Кудра и Е.Гитман предложили следующие исходные положения:
1) выделение плотного слоя металла на катоде происходит до тех пор, пока концентрация С катионов Me ɀ + у катода не снизится до какой-то определенной величины С0, при которой уже начинает выделяться рыхлый осадок (металл);
2) при включении тока выделяются сразу только близлежащие к электроду ионы Me ɀ + и притом расположенные в электролите не дальше определенного расстояния h;
3) в момент выделения рыхлого осадка концентрация катионов меz+ в прилегающем к катоду объеме электролита имеет постоянно возрастающее значение от С0 у самой поверхности катода до С на расстоянии h от его поверхности;
4) при данной плотности тока и для определенной соли выделяемого металла изменение концентрации dC/ dh от С0 до С - величина постоянная, в связи с чем расстояние h меняется пропорционально изменению концентрации С, а с возрастанием плотности тока возрастает и величина dC/ dh (концентрация при более быстром выделении катионов Me ɀ + у катода не успевает выравниваться).
Таким образом,
dC/dh = (3.85)
где N - коэффициент пропорциональности.
При работе с малыми плотностями тока С0 обычно не достигается, так как убыль ионов Meɀ+ постоянно пополняется (главным образом за счет диффузии), вследствие чего происходит выделение плотных осадков. На оборот, при больших плотностях тока концентрация ионов Meɀ+ у катода резко падает и через короткое время достигает значения С0, при котором и начинает выделяться рыхлый осадок.
При работе с малыми плотностями тока С0 обычно не достигается, так как убыль ионов Me ɀ + постоянно пополняется (главным образом за счет диффузии), вследствие чего происходит выделение плотных осадков. Наоборот, при больших плотностях тока концентрация ионов Me ɀ + у катода резко падает и через короткое время достигает значения С0, при котором и начинает выделяться рыхлый осадок.
Рассмотрим процесс образования осадка при высоких плотностях тока, обозначив начальную концентрацию ионов Me ɀ + через С. Если выделить элементарную площадку S на катоде и допустить, что при включении тока на ней выделяются лишь те катионы, которые находятся вблизи электрода и расположены не дальше определенного расстояния h, то до момента образования рыхлого осадка из прилегающего к площадке S объема Sh их выделилось бы (С - C0)Sh, при одинаковой разности концентраций (С - С0) во всем объеме Sh. На самом деле она на протяжении h меняется и при постоянстве dC/dh в пределах одной плотности тока количество разрядившихся катионов составит [(С - С0)/2] Sh, что иллюстрирует рис. 31-89.
Рисунок 31- Зависимость концентрации катионов С от расстояния до катода h
По закону Фарадея должно иметь место равенство
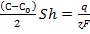 , (3.86)
, (3.86)
где q - количество кулонов электричества, протекающего через площадку S катода; ɀ- валентность выделяемого металла; F - число Фарадея, равное 96520.
Проинтегрировав выражение (3.85)
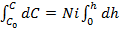 ,
,
Подставим это значение h в уравнение (3.86):
(С – C 0)2S/2 Ni =q/ɀF (3.87)
С учетом того, что q = iSr (t - время выделения осадка на катоде), выражение (3.87) принимает вид
(C - C 0)2= 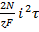
Полагая, что С 0 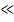 С, приходим к очень простой зависимости
С, приходим к очень простой зависимости
C= ai τ0,5 (3.88)
где а= 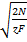
При выводе формулы (3.88) вследствие незначительности при катодного слоя пренебрегают изменением его концентрации за счет диффузии, которое необходимо учитывать при установившемся медленном процессе электролиза.
Между плотностью тока i и временем τ существует гиперболическая зависимость, означающая, что при любой (даже самой большой) плотности тока сначала, хотя и очень недолго, должен выделяться плотный осадок. В связи с этим нельзя утверждать, что при какой-либо достаточно высокой плотности тока выделяется только рыхлый осадок. Условно можно принять, что если за одну секунду после включения тока на катоде начнет выделяться рыхлый осадок, то необходимая для этого плотность тока практически соответствует выделению рыхлого осадка при данной концентрации катионов в электролите: Для этого случая (τ 0,5=1) зависимость плотности тока от концентрации ионов выделяемого металла определяется выражением i =(1/ a) или КС, где К = 1/ а.
Результатами многочисленных опытов доказано, что, подбирая плотности тока, соответствующие наибольшему времени τ, при котором для данной концентрации катионов в электролите еще выделяются рыхлые осадки, трудно достичь τ 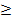 20
20 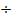 25 с. Объясняется это тем, что при достигнутых плотностях тока убыль ионов выделяемого металла у катода успевает постоянно пополняться за счет диффузии, и появление рыхлых осадков не наблюдается. На основании этого устанавливают предельную плотность тока, практически соответствующую выделению только плотных осадков, которая определяется выражением (при τ= 25 с величина τ 0,5= 5) i = [1/(5 а)] С или i = 0,2КС.
25 с. Объясняется это тем, что при достигнутых плотностях тока убыль ионов выделяемого металла у катода успевает постоянно пополняться за счет диффузии, и появление рыхлых осадков не наблюдается. На основании этого устанавливают предельную плотность тока, практически соответствующую выделению только плотных осадков, которая определяется выражением (при τ= 25 с величина τ 0,5= 5) i = [1/(5 а)] С или i = 0,2КС.
Константы для различных солей металлов, как это видно из табл. 5, мало отличаются одна от другой, а для сульфатов они вообще одинаковы и меньше по величине, чем для других солей металлов. Это дает возможность при ориентировочных определениях предела выделения соответственно плотных или рыхлых осадков для любых солей пользоваться значением константы сульфатов. В этом случае допустимая плотность тока при электролизе должна удовлетворять выражению либо i 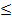 0,2 КС (принимая константу сульфатов К= 0,53, получаем i
0,2 КС (принимая константу сульфатов К= 0,53, получаем i 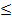 0,11 С, т.е. приблизительно i
0,11 С, т.е. приблизительно i 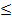 0,1 С), либо i
0,1 С), либо i 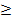 КС (при i
КС (при i 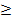 0,53С для сульфатов).
0,53С для сульфатов).
Более наглядная картина получается при графическом изображении соотношения между i и С. Если по оси абсцисс отложить концентрации катионов выделяемого металла С, а по оси ординат плотности тока i, то полученные пределы i 1 = КС и i2 = 0,2КС будут выражены прямыми, проходящими через начало координат, которые делят все поле на три части (рис.32). Как следует из предыдущих рассуждений, переходная зона соответствует появлению рыхлого осадка в интервале времени 1-25с.
Таблица 5-12 - Численные значения констант а и К для некоторых солей металлов
Из этого же графика следует, что в отличие от плотных осадков рыхлые получаются из менее концентрированных водных растворов.
Рисунок 32 - Диаграмма i-C: I –область рыхлых осадков; II - переходная зона;
III - область плотных осадков
Если повысить концентрацию в электролите ионов выделяемого металла, то соответственно расширяется область плотных осадков и, наоборот, при снижении их концентрации область рыхлых осадков расширяется. Это связано но с механизмом образования осадка: выделение металла на катоде начинается в отдельных местах его поверхности - первичных центрах кристаллизации, и повышение концентрации разряжающихся катионов создает их ускоренное питание, в результате чего формируется плотный осадок. Важным является то обстоятельство что повышение концентрации электролита в пределах значений, соответствующих выделению рыхлых осадков, вызывает увеличение скорости роста кристаллов (частиц), т.е. осадок получается более крупнозернистым.
Рисунок 33 - Зависимость гранулометрического состава порошка
меди от плотности тока i, А/дм2 (цифры у кривых)
Установлено, что при прочих равных условиях на дисперсность порошка влияет величина плотности тока. Если по ординате отложить содержание фракции порошка в процентах по массе, а по абсциссе средний размер частиц, то для каждой выбранной плотности тока получаются кривые гранулометрического состава порошка с максимумом, соответствующим тому размеру зерен, который наиболее типичен для данной плотности тока (рис. 33). Чем выше плотность тока, тем дисперснее получаемый порошок, так как на единице площади катода в единицу времени разряжается больше ионов, т.е. создаётся много первичных центров кристаллизации и скорость их уменьшается.
Температура электролита также влияет на процесс электролиза: повышение температуры вызывает возрастание концентраций ионов в прикатодном слое, так как возрастает их подвижность, что содействует формированию плотных осадков, и, наоборот, для получения рыхлых осадков нужно пользоваться электролитами с относительно низкими температурами.
Наличие в электролите растворенного кислорода, пероксида водорода и других окислителей вызывает окисление поверхности катода, в результате чего она становится неоднородной, способствуя тем самым образованию рыхлых осадков. Присутствующие в электролите коллоиды и органические поверхностно-активные вещества в процессе электролиза адсорбируются на поверхности растущих граней кристаллов и препятствуют их дальнейшему росту; осадок получается рыхлым.
Ниже приведены примеры получения металлических порошков электролизом водных растворов.
Получение медного порошка. Электролитический способ получения медного порошка известен с 1865 г. В бывшем СССР такой способ разработан в 1934 г. и в настоящее время в России он является практически монопольным, обеспечивая производство медного порошка высокой чистоты, требуемой зернистости, с хорошими технологическими свойствами. Существенными недостатками метода являются его сравнительная дороговизна, большой расход электроэнергии и невысокая производительность.
На рис. 34 приведена технологическая схема производства медного порошка электролизом кислого раствора сернокислой меди. Анодами (плиты размером 880 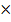 980
980 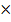 10 мм) служит чистая катодная медь марки МОСТП 48-0318-009-80 по ГОСТ 546-79 (плавленную черновую медь не применяют, так как она загрязнена мышьяком, сурьмой и свинцом, которые переходят в порошок), что существенно удорожает получаемый медный порошок. В промышленном электролизе в качестве анодов используют катоды, получаемые при электрорафинировании черновой меди, либо аноды изготавливают из медного проката или применяют литые аноды.
10 мм) служит чистая катодная медь марки МОСТП 48-0318-009-80 по ГОСТ 546-79 (плавленную черновую медь не применяют, так как она загрязнена мышьяком, сурьмой и свинцом, которые переходят в порошок), что существенно удорожает получаемый медный порошок. В промышленном электролизе в качестве анодов используют катоды, получаемые при электрорафинировании черновой меди, либо аноды изготавливают из медного проката или применяют литые аноды.
Электролит представляет собой сернокислый (125-180 г/л H2S04; исходная серная кислота марка А по ГОСТ 2184-77 с содержанием моногидрата 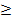 92,5 %) раствор сульфата меди CuSО4 (исходный медный купорос содержит
92,5 %) раствор сульфата меди CuSО4 (исходный медный купорос содержит 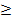 89,2 % CuSО4·5H2О и
89,2 % CuSО4·5H2О и 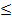 0,06% Fe, 0,015 % As и 0,25% H2SО4). Вещества, составляющие электролит, диссоциируют с образованием катионов меди Cu2+ и водорода H+ и анионов S
0,06% Fe, 0,015 % As и 0,25% H2SО4). Вещества, составляющие электролит, диссоциируют с образованием катионов меди Cu2+ и водорода H+ и анионов S 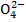 и OH-.
и OH-.
Выделение порошка проводят чаще все на медных катодах пластинчатого (листы катодной меди размером 830  930 мм и толщиной 3-4 мм) или стержневого (7 или 8 медных трубок длиной 1 м, диаметром 12, 14 или 16 мм и толщиной стенок 3 мм при расстоянии между ними от 150 до 115 мм) типа. Анодов в ванне электролизера всегда на один больше, чем катодов (например, 12 листовых катодов и 13 анодов, 15 или 16 стержневых катодов и 16 или 17 анодов соответственно), так что крайними являются аноды и при электролизе вся поверхность любого из катодов рабочая. Расстояние между центрами одноименных электродов около 150 мм. Ниже приведены рекомендуемые состав электролита и режим электролиза:
930 мм и толщиной 3-4 мм) или стержневого (7 или 8 медных трубок длиной 1 м, диаметром 12, 14 или 16 мм и толщиной стенок 3 мм при расстоянии между ними от 150 до 115 мм) типа. Анодов в ванне электролизера всегда на один больше, чем катодов (например, 12 листовых катодов и 13 анодов, 15 или 16 стержневых катодов и 16 или 17 анодов соответственно), так что крайними являются аноды и при электролизе вся поверхность любого из катодов рабочая. Расстояние между центрами одноименных электродов около 150 мм. Ниже приведены рекомендуемые состав электролита и режим электролиза:
Катодная плотность тока, N м2........................................1800 -3250
Концентрация ионов меди, г/л…………………………….10-16
Концентрация серной кислоты, г/л……………………….125-180
Температура электролита, 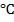 ………………………………48-55
………………………………48-55
Циркуляция электролита, л/мин…………………………..40-60
Напряжение на ванне, В……………………………………1,3-1,7
Рисунок 34 - Технологическая схема получения электролитического медного порошка:
1 - плавильное устройство; 2 - узел корректировки электролита; З - электролиз;
4 - промывка, стабилизация и отжатие (обезвоживание) порошка;
5 - приготовление стабилизирующего раствора; 6, 9, 12 - бункеры-накопители порошка;
7 -сушка порошка; 8 - элеватор; 10 - измельчение; 11 -классификация; 13 - смешивание и упаковка;
14 - готовая продукция; 15, 16 - ловушка для порошка; 17 - узел регенерации электролита
Могут применяться катоды не из меди, а из других металлов: алюминиевые (эффективны при плотностях тока 2500А/м2 и выше, температуре электролита 30-35 °С и кислотности 120-140 г/л), титановые (эффективны при плотности тока 1400-1600А/м2, температуре электролита 35-40°С и кислотности < 100 г/л), свинцово-сурьмянистые с 6 % Sb (эффективны при плотности тока до 1200А/м2, температуре электролита 40-45°С, кислотности 160 г/л).
Конструкции ванн для электролиза различные: ящичного (рис. 35, а; емкостью 2-5м3) или бункерного (рис. 35,б) типа с деревянным, железобетонным или металлическим каркасом, футерованным кислотостойким материалом (винипластом, сурьмянистым свинцом), из кислотостойких пластмасс или пластика, армированного стекловолокном. Ванны в электрическую цепь включают последовательно, а электроды в них -параллельно (рис. 35, 36). В связи с этим одинаковы сила тока (8000- 12500 А) в каждой из 17-24-х ванн серии и напряжение между электродами, соответствующее величине напряжения на ванне.
Порошок меди снимают с катода специальными скребками из нержавеющей стали, полимеризованных смол и других материалов обычно через 60-120 мин работы ванны (максимальное время наращивания порошка на стержневых катодах 8 ч). Разработаны различные методы механизированного съема катодного осадка (скребком с вращающегося катода, электроимпульсным методом путем создания пульсирующей волны в электролите при кратковременном разряде между катодами и анодами большой мощности при высоком напряжении и др.).
Рисунок 35- Разрез ванны электролизера ящичного типа (а), бункерного типа (б):
1 - карман для приема электролита; 2 - промежуточная шина; З - анод; 4 - катод;
5 - лоток для выпуска электролита; 6 - корпус электролизера; 7 - устройство для выгрузки порошка;
8 - карман для подачи электролита
Для устранения пассивации анодов в электролите поддерживают концентрацию хлор-иона на уровне 0,5-4 мг/л. Большее количество хлор-ионов вредно, так как возможно образование полу-хлористой меди, дающей коллоидный осадок, который нарушает нормальный ход электролиза. Хлор-ионы в электролит поступают с водой, к которой добавляют поваренную соль NaCl или соляную кислоту HCl.
Циркуляция и регенерация электролита. При электролизе под кисленного раствора сульфата меди на катоде протекают реакции Сu + 2 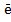 = Сuи H++
= Сuи H++ 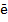 = 0,5Н2.Кроме того, имеет место химическое растворение некоторого количества выделившейся меди (до 2-2,5 %) вследствие сильно развитой поверхности образующегося порошка: Cu+0,5O2+H2SO4=CuSO4+H2O На аноде происходит растворение меди и ее переход в электролит Сu- 2
= 0,5Н2.Кроме того, имеет место химическое растворение некоторого количества выделившейся меди (до 2-2,5 %) вследствие сильно развитой поверхности образующегося порошка: Cu+0,5O2+H2SO4=CuSO4+H2O На аноде происходит растворение меди и ее переход в электролит Сu- 2 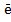 = Сu2 + (в незначительном количестве образуются ионы Сu+) при анодном коэффициенте использования тока 100 %.
= Сu2 + (в незначительном количестве образуются ионы Сu+) при анодном коэффициенте использования тока 100 %.
Таким образом, прикатодное пространство обедняется катионами меди и обогащается ионами S 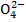 , а прианодное пространство и электролит в целом обогащаются ионами меди.
, а прианодное пространство и электролит в целом обогащаются ионами меди.
Рисунок 36- Поперечный разрез блока ванн: 1 - бортовая шина; 2 - катод; З - катодная штанга;
4 - про межуточная шина; 5 -анод; 6 -по перечная стенка ванны
Выравнивание концентрации этих ионов в объеме электролита осуществляет системой непрерывной замкнутой циркуляции (рис. 37), при которой за 1 ч происходит примерно десятикратным обмен электролита в каждой ванне.
Рисунок 37 - Система циркуляции электролита
Электролит из ванны 1 через лоток 6 сливается в сборную трубу 12, из которой он либо поступает в сборный бак 11, либо выводится из электролиза. Из сборного бака 11 электролит центробежным насосом 10 перекачивается через теплообменник 9 в напорный бак 7. В теплообменнике 9 электролит проходит через множество параллельных трубок из кислотостойкой нержавеющей стали, омываемых холодной водой. Регулируя скорость поступления воды, температуру электролита поддерживают на заданном уровне. В напорном баке 7, установленном на высоте, обеспечивающей поддержание постоянного напора электролита в 2-3 м, на определенном уровне врезана переливная труба 8 отводящая избыток электролита в сборный бак 11. Основная масса электролита из разводящей трубы 5 подается к распределительным трубам 4 на блоках ванн. Из распределительной трубы 4 электролит по рожкам 2 через карманы 3 поступает в ванну 1 и цикл циркуляции повторяется.
Одновременно с циркуляцией осуществляют регенерацию электролита, так как в процессе электролиза происходит существенное изменение его состава: электролит обогащается медью за счет некоторого растворения катодного осадка и неполного выделения меди из электролита (меньшего, чем в соответствии с законом Фарадея; за сутки содержание меди в электролите может возрасти на 20-30 % против исходного) из-за расхода части электричества на разрядку ионов водорода (выход по току составляет 80-90 %, т.е. катодный коэффициент полезного использования тока не превышает 90 %) и обедняется серной кислотой, затрачиваемой на растворение катодной меди и в связи с выделением водорода на катоде. Кроме того, в электролите происходит постепенное накапливание примесей (мышьяка, сурьмы, железа и др.), попадающих в него по мере растворения анода. Для обеспечения постоянства заданного состава проводят корректировку электролита включая в систему сблокированных ванн специальные регенеративные ванны с нерастворимыми анодами свинцовыми (Рb Рb + 1 %Ag Рb + 6 % Sb) или из платинированного титана (например, каждая пятая, шестая или седьмая ванна в серии). Общее (суммарное) требуемое количество регенеративных ванн п можно подсчитать по формуле
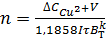 (3.89)
(3.89)
где 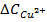 - прирост концентрации меди в электролите за время электролиза τ (ч), г/л; V - суммарный объем электролита во всех ваннах работающих электролизеров, л; I - сила тока, проходящего через электролит, А;
- прирост концентрации меди в электролите за время электролиза τ (ч), г/л; V - суммарный объем электролита во всех ваннах работающих электролизеров, л; I - сила тока, проходящего через электролит, А; 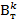 - катодный коэффициент полезного использования тока (в долях единицы). В таких ваннах выделение меди на катоде уменьшает концентрацию ее катионов в электролите, а на аноде образуется кислород и происходит регенерация серной кислоты по реакциям
- катодный коэффициент полезного использования тока (в долях единицы). В таких ваннах выделение меди на катоде уменьшает концентрацию ее катионов в электролите, а на аноде образуется кислород и происходит регенерация серной кислоты по реакциям 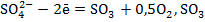 +H2O=H2SO4. По мере накапливания примесей часть электролита выводят из системы циркуляции, а вместо него вводят свежеприготовленный электролит.
+H2O=H2SO4. По мере накапливания примесей часть электролита выводят из системы циркуляции, а вместо него вводят свежеприготовленный электролит.
Правила техники безопасности требуют от рабочих осмотрительности при приготовлении электролита и обслуживании ванн электролизера. Запрещается касаться токопроводящих шин на ваннах металлическими предметами, а тем более соединять ими главные токоведущие шины на серии или шины двух соседних серий. Несоблюдение этих требований может привести к удару током или ожогу от вольтовой дуги, возникающей при коротком замыкании. Во избежание ожогов перед включением серии тщательно зачищают рубильник и концы шин, а в момент включения плотно прижимают рубильник к шинам. При временном разрыве электрической цепи на серии ванн с образованием вольтовой дуги запрещается подходить к этим ваннам, пока не снято напряжение с цепи, в которой произошел разрыв. Нельзя складывать токопроводящие материалы У шин, питающих серии ванны. Включение и выключение регенеративных ванн можно производить только при выключенной серии. Запрещается выбрасывать катоды из работающей регенеративной ванны и проверять ее исправность металлическими инструментами, так как появление искры может вызвать взрыв или возгорание (на ванне одновременно выделяются кислород и водород). Зеркало электролита в регенеративных ваннах должно быть покрыто вспенивающимся материалом (например, маслом), предотвращающим распыление электролита в атмосферу цеха. При замене электродов на ваннах надо остерегаться их падения, в особенности при замене отработанных анодов. В случае попадания на тело серной кислоты или электролита необходимо немедленно смыть их сильной струей воды или содовом раствором.
Промывка и стабилизация порошка. Медный порошок, счищенный с катодов, выгружают из ванны периодически без ее отключения при помощи гидровакуумной системы. Для удаления механически захваченного электролита порошок промывают горячей водой на нутч-фильтрах или в аналогичных им по конструкции специальных промывателях, в которых вода фильтруется через слой порошка, находящегося на перфорированном (сетчатом) днище из нержавеющей стали. Для качественной промывки порция порошка должна иметь одинаковую фильтрующую способность по всей высоте и поверхности слоя. Полнота отмывки определяется реакцией на наличие катионов меди в воде после промывки; отсутствие окрашивания раствора желтой кровяной соли или 5%-ного аммиака указывает на завершение промывки. Расход воды составляет около 10м3 на 1 т порошка.
Пленка воды на частицах порошка приводит к их коррозии, изменяющей физико-химические и технологические свойства порошка. В связи с этим применяют стабилизацию порошка, промывая его после обработки горячей водой раствором хозяйственного мыла или мылонафта (получают в процессе очистки керосина; стоимость в 10 раз меньше стоимости мыла), содержащим их в количестве 400 г на 1 м3 воды. На частицах создается гидрофобная пленка, защищающая медь от коррозии (коррозионная стойкость порошка повышается в 70-80 раз). Расход стабилизирующего раствора составляет 6 м3 на 1 т порошка. Затем избыток стабилизатора удаляют промывкой порошка холодной водой. Избыточное давление растворов и воды должно быть 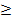 0,5 МПа для слоя порошка высотой 1 м. После промывки порошок обезвоживают и сушат.
0,5 МПа для слоя порошка высотой 1 м. После промывки порошок обезвоживают и сушат.
Получение серебряного порошка. Порошок получают электролизом раствора азотнокислого серебра AgNO3 Используют электролит состава 10-15 г/л азотной кислоты и 40 г/л азотнокислого серебра (25 г/л Ag+) с температурой 35-40 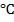 . Плотность тока составляет 1400-1500 А/м2, напряжение на ванне 2-2,8 В. Анод - прокатанное серебро, катод алюминиевый. По ГОСТ 9724-61 про изводят порошки марок ПСl и ПС2 с содержанием серебра
. Плотность тока составляет 1400-1500 А/м2, напряжение на ванне 2-2,8 В. Анод - прокатанное серебро, катод алюминиевый. По ГОСТ 9724-61 про изводят порошки марок ПСl и ПС2 с содержанием серебра 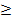 99,9 % и остальных элементов, %,не более: 0,02 Сu, 0,001 NO3, 0,005 SO4, 0,04 Fe, Bi, РЬ, Sb, А1 в сумме. Влажность порошка не должна превышать 0,08%.
99,9 % и остальных элементов, %,не более: 0,02 Сu, 0,001 NO3, 0,005 SO4, 0,04 Fe, Bi, РЬ, Sb, А1 в сумме. Влажность порошка не должна превышать 0,08%.
Получение железного порошка. Принципиальная схема приведена на рис. 86. В ряду напряжений железо располагается левее водорода и в кислых электролитах на катоде интенсивно выделяется водород, существенно снижая выход по току и ухудшая качество порошка железа. Кроме того, в электролите может образовываться Fe(OH)3, загрязняющий катодный осадок и нарушающий непрерывность процесса электролиза.
Растворимые аноды могут быть из чугунного или низкоуглердистого стального лома, литья, обрезков железных листов, стружки с содержанием углерода 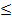 0,6 % (масс.) и т.п. Катоды изготавливают в основном в виде пластин из нержавеющей (коррозионностойкой) стали.
0,6 % (масс.) и т.п. Катоды изготавливают в основном в виде пластин из нержавеющей (коррозионностойкой) стали.
Электролиз ведут либо на получение плотного хрупкого осадка железа, либо получая его мягкий осадок.
Катодный осадок первого типа может быть получен следующим образом. Аноды, очищенные на пескоструйном аппарате от оксидной пленки, помещают в мешки-диафрагмы для устранения механического засорения катодного осадка анодным шламом. Электролит поступает в железобетонные ванны с винипластовой футеровкой из напорного бака, а из ванн стекает в сливной бак, откуда его вновь перекачивают в напорный бак. Состав электроли
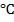 , скорость циркуляции 8-10 л/мин. Напряжение на ванне 1,5-1,7 В, катодная плотность тока 400-500 А/м2.
, скорость циркуляции 8-10 л/мин. Напряжение на ванне 1,5-1,7 В, катодная плотность тока 400-500 А/м2. Получение порошков сплавов. Несмотря на кажущуюся простоту, электролитическое выделение многокомпонентных металлических порошков в промышленных масштабах не осуществляют прежде всего из-за быстрого изменения состава электролита в процессе электролиза, что приводит к получению на катоде порошка меняющегося химического состава и дисперсности.
Перспективным является проведение электролиза с несколькими растворимыми анодами из индивидуальных компонентов, входящих в состав сплава.
При получении двухкомпонентного железокобальтового порошка предложено в электролизере располагать три анода: два растворимых -железный и кобальтовый, один нерастворимый -свинцовый, используемый в сочетании с дополнительным электродом из железной сетки; катод - никелевый или из нержавеющей стали. Электролизер питается током от трех выпрямителей с регулируемым напряжением, что позволяет независимо регулировать токи, проходящие через аноды. Электролит представляет собой смешанный подкисленный H2SО4 до рН 2-2,5 раствор сульфатов железа FeSО4 и кобальта CoSО4 при суммарном содержании металлических катионов 15г/л; в раствор добавлены, г/л: 30 (NH4)2SО4 40 и 40 ~SО4 Температура электролита 20-25 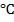 , катодная плотность тока 1000-3000 А/м2.На катоде совместно разряжаются ионы железа, кобальта и водорода. Предложено выражение для расчета токов I а, протекающих через кобальтовый и железный аноды:
, катодная плотность тока 1000-3000 А/м2.На катоде совместно разряжаются ионы железа, кобальта и водорода. Предложено выражение для расчета токов I а, протекающих через кобальтовый и железный аноды:
I а (Co)/ I а (Fe) = ([Со]/[Fе])раств = ([Со]/[Fе])пор,
где [Со], [Fe] - соответственно концентрация кобальта или железа в растворе (электролите) и порошке. Ток на свинцовом аноде должен соответствовать сумме токов на катоде и сетке. Меняя соотношение Со2+/ Fe2+ в растворе и, соответственно, соотношение анодных токов, можно получать железокобальтовые порошки любого заданного состава от чистого железа до чистого кобальта с размером частиц от нескольких до сотен микрометров.
Аналогично рассмотренному, могут быть получены железоникелевые порошки любого заданного состава. В электролизере располагают два растворимых анода из малоуглеродистого железа и никеля и один нерастворимый анод из угля или графита, применяемый в сочетании с дополнительным электродом из железной или никелевой сетки. Анодные токи регулируют независимо друг от друга, как указано выше. Электролитом служит подкисленный соляной кислотой до рН 2,5 смешанный раствор сульфатов железа FeSО4 и никеля NiSО4 при суммарном содержании металлических катионов 12-15 г/л; в раствор добавлены, г/л: 12-15 NH4Cl (буферная добавка) и 20-40 NaCl (для устранения пассивации никелевого анода и повышения электропроводности раствора). Температура электролита 20-30 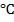 . Катодная плотность тока зависит от соотношения Ni2+ /Fe2+ в растворе: при Ni2+ /Fe2+ = 0,2-0,5 обеспечивают 400-1500 А/м2, при Ni2+/Fe2+ = 1используют 2000- 20000 А/м2, при Ni2+/Fe2 = 2-5 процесс ведут при 4000-20000 А/м2. Размер частиц порошка зависит от катодной плотности тока и при ее величине в 3000 А/м2 не превышает 200-300 мкм.
. Катодная плотность тока зависит от соотношения Ni2+ /Fe2+ в растворе: при Ni2+ /Fe2+ = 0,2-0,5 обеспечивают 400-1500 А/м2, при Ni2+/Fe2+ = 1используют 2000- 20000 А/м2, при Ni2+/Fe2 = 2-5 процесс ведут при 4000-20000 А/м2. Размер частиц порошка зависит от катодной плотности тока и при ее величине в 3000 А/м2 не превышает 200-300 мкм.
Бронзовый порошок (92 % Cu и 8 %Sn) получают из лимоннокислого электролита, содержащего CuC12, SnCl2 и цитрат натрия (комплексообразователь) при соотношении ионов Cu2+/Sn2+=1,065; плотность тока 1600 А/м2, температура электролита 30 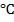 , рН 2. Можно использовать триполифосфатный электролит, содержащий сульфат меди и хлорид олова.
, рН 2. Можно использовать триполифосфатный электролит, содержащий сульфат меди и хлорид олова.
Известны условия получения порошков сплавов Cu-Pb и Ag-Cu.
В целом опыт промышленного производства электролитических дисперсных порошков сплавов недостаточен из-за сложного технологического и аппаратурного оформления процесса.
Получение порошков из производственных растворов и сточных вод металлургических производств. Последние десятилетия характеризуются бурным развитием металлургии, горного дела, металлообработки, машиностроения и особенно химической промышленности. Большое количество разбавленных растворов, содержащих ионы цветных металлов, образуется при выщелачивании руд и отвалов рудников. Громадный объем имеют и промышленные стоки металлургических заводов. Много растворов образуется так же в гальванических цехах. Из указанных растворов в настоящее время извлекают многие цветные металлы, используя различные физико-химические методы, в том числе и электролиз. Наличие большого количества производственных растворов повышает требования к увеличению производительности соответствующих способов их переработки. Кроме того, организация извлечения металлов из сильно разбавленных растворов (концентрация металлических ионов < 1 г/л) является технически сложной.
Помимо важных экономических аспектов проблемы, отметим также экологическую сторону выбора способа очистки, так как по существующему в большинстве промышленно развитых стран законодательству имеются строгие ограничения по суммарному содержанию ионов металлов в сточных водах (в странах Западной Европы суммарное содержание цинка, кадмия, меди, железа, никеля не должно превышать 15  10-3г/л). Такие высокие требования объясняются тем, что ионы цветных металлов, содержащихся в таких стоках, обладают комплексом токсических действий на человека, живую природу и микроорганизмы.
10-3г/л). Такие высокие требования объясняются тем, что ионы цветных металлов, содержащихся в таких стоках, обладают комплексом токсических действий на человека, живую природу и микроорганизмы.
При переходе на современные методы хозяйствования и существующей остроте проблемы обеспечения промышленности сырьем, извлечение металлов из разбавленных растворов становится важной технико-экономической задачей. В настоящее время таким образом можно дополнительно получить тысячи тонн цветных металлов, в основном в виде порошков. Особенно актуальна задача разработки и внедрения новых способов извлечения золота из растворов флотации и гидрометаллургии золотоносных руд; для извлечения серебра из растворов от обработки кино-фотоматериалов и из отработанных гальванических растворов; для выделения меди, цинка, кадмия, никеля, кобальта, марганца, олова, свинца, ртути из травильных растворов и сточных вод металлургических производств.
В последние годы разработаны принципиально новые электролитические способы извлечения металлов с применением высокоповерхностных электродов. Серьезные исследования привели к созданию в Англии, Франции, ФРГ, Швейцарии, Голландии, Японии, США и Испании, а также в нашей стране промышленных установок для проведения таких процессов. Их принципиальными преимуществами являются: большая площадь электродной поверхности, что позволяет резко увеличить силу тока на ванне; высокая скорость массопереноса в объеме электролита, что резко снижает концентрационную поляризацию; возможность непрерывного ввода в процесс обрабатываемого раствора.
 2015-06-04
2015-06-04 3251
3251