Закон действующих масс был выведен с использованием закона состояния идеальных газов и применим в первую очередь к газовым смесям. Однако его без существенных изменений можно применить и к значительному числу гетерогенных равновесий, например, с участием твердых веществ и газов.
В этом случае газы составляют общую газообразную фазу и их химические потенциалы при условии применимости закона идеальных газов можно записать в известном виде (смотри (III,46)):
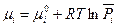
Для твердых участников реакции наиболее просто дело обстоит, когда они, не образуя твердых растворов, кристаллизуются в виде отдельных фаз, представляющих собой чистые вещества. Так, например, при реакциях
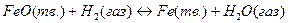 и
и
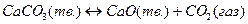
твердые вещества FeO и Fe, а также CaCO3 и CaO не растворяются одно в другом и образуют самостоятельные фазы. В таком случае химические потенциалы отдельных твердых веществ, рассчитанные на 1 моль, не зависят от их относительных количеств. Поэтому при постоянных температуре и давлении химические потенциалы твердых участников реакции постоянны.
Из сказанного следует, что в константу равновесия реакций этого типа входят лишь парциальные давления газообразных участников реакции.
Так, для реакции
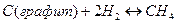
константу равновесия следует записать так:
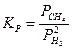
А для реакции обжига карбоната кальция
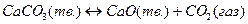
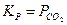 , т.к. здесь всего один газообразный участник химического превращения.
, т.к. здесь всего один газообразный участник химического превращения.
Несмотря на то, что константа равновесия гетерогенной реакции выражается через парциальные давления только газообразных реагентов, величина 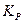 зависит от свойств всех участников реакции.
зависит от свойств всех участников реакции.
Так, при термической диссоциации MgCO3 и CaCO3 выражение для константы одно и то же (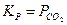 ), но величина ее различна, так как химические потенциалы MgCO3 и MgO отличаются от химических потенциалов CaCO3 и CaО.
), но величина ее различна, так как химические потенциалы MgCO3 и MgO отличаются от химических потенциалов CaCO3 и CaО.
 2015-06-04
2015-06-04 649
649








