Поверхностное натяжение относится к числу наиболее важных свойств дисперсных систем и является основной термодинамической характеристикой поверхности раздела. Рассмотрим наиболее простой случай – поверхностное натяжение жидкости на границе с газом (рис. 2.1).
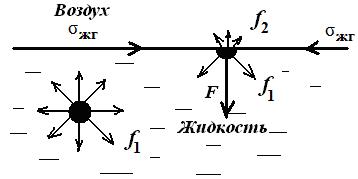
Рис. 2.1. Межмолекулярное взаимодействие
внутри жидкости и на поверхности раздела фаз
На молекулу, находящуюся внутри жидкости, действуют силы взаимного притяжения (силы молекулярного сцепления) со стороны всех окружающих ее соседних молекул. Равнодействующая этих сил равна нулю вследствие симметрии силового поля, и для перемещения молекулы внутри жидкости не требуется затрачивать работу. Это вызвано тем, что в газообразной фазе молекулы удалены друг от друга на большие расстояния, и действующие между ними силы взаимного притяжения очень малы. Молекулы, находящиеся на границе раздела фаз, испытывают действие межмолекулярных сил в большей степени со стороны жидкой фазы f 1, чем со стороны газообразной f 2(f 1 >> f 2). Результирующая сила F, пропорциональной разности сил (f 1 – f 2), направлена внутрь жидкости. Эта сила, отнесенная к единице поверхности (1 м2 или 1 см2), называется внутренним (молекулярным) давлениемpM:
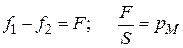 .
.
Молекулярное давление определяется силой сцепления молекул, оно тем выше, чем полярнее вещество, так для H2O величина рМ равна 14000 атм, для C6H6 – 3800 атм. Таким образом, на поверхности любой жидкости существует огромное давление, вызванное нескомпенсированностью молекулярных сил сцепления в поверхностном слое и стремящееся затянуть все молекулы с поверхности внутрь жидкой фазы. Этим объясняется шарообразная форма капель жидкости.
Поверхностный слой вследствие нескомпенсированности молекулярных сил имеет избыточную свободную энергию по сравнению с объемом жидкости. Этот избыток свободной энергии, отнесенный к единице поверхности (1 м2 или 1 см2), называется удельной свободной поверхностной энергией (поверхностным натяжением). Весь избыток поверхностной энергии заключен в слое толщиной в 1 молекулу. Наличие на поверхности раздела фаз избытка энергии означает, что для образования новой поверхности требуется совершить работу.
Поверхностное натяжение (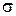 ) – работа обратимого изотермического процесса, затраченная на образование единицы площади поверхности раздела фаз (энергетическое определение поверхностного натяжения):
) – работа обратимого изотермического процесса, затраченная на образование единицы площади поверхности раздела фаз (энергетическое определение поверхностного натяжения):
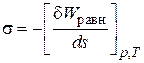 . (2.2)
. (2.2)
Знак минус говорит о том, что положительная работа совершается при уменьшении или сокращении поверхности.
Силовое определение: поверхностное натяжение – сила, направленная тангенциально (параллельно) к поверхности и приходящаяся на единицу длины периметра, ограничивающего эту поверхность.
Физическая сущность – поверхностные молекулы стремятся уйти вглубь конденсированной фазы, тем самым, сжимая поверхность.
Оба эти определения необходимо рассматривать в единстве. Такое единство энергетического и силового подходов сложилось исторически. Величина поверхностного натяжения была введена в физику задолго до появления понятия энергии и рассматривалась как сила, стягивающая гипотетическую пленку на поверхности жидкости и противодействующая ее растяжению. Силовое определение более справедливо для жидкостей, т.к. у них одновременно с образованием поверхности молекулы и атомы на ней ориентируются, уплотняются, переходя в равновесное состояние и вызывая тем самым тангенциальное натяжение поверхности.
2.2.2. Термодинамическое определение
поверхностного натяжения
При p и Т = const запишем объединенное уравнение первого и второго начал термодинамики для гетерогенной системы относительно изменения энергии Гиббса:
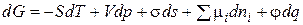 , (2.3)
, (2.3)
где Т – температура; S – энтропия; р – давление; V – объем; s – площадь поверхности; 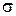 – поверхностное натяжение;
– поверхностное натяжение; 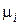 – химический потенциал i- го компонента; ni – число моль i -го компонента;
– химический потенциал i- го компонента; ni – число моль i -го компонента; 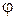 – электрический потенциал; q – количество электричества.
– электрический потенциал; q – количество электричества.
При постоянных Т, р, ni и q имеем
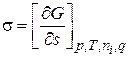 . (2.4)
. (2.4)
Поверхностное натяжение есть частная производная от энергии Гиббса по площади поверхности раздела фаз при постоянных: давлении, температуре, числе моль компонентов и заряде.
Так как объединенное уравнение первого и второго начал термодинамики может быть записано и относительно других термодинамических потенциалов, а именно внутренней энергии U, энергии Гельмгольца А, и энтальпии H, то при соответствующих постоянных параметрах получим
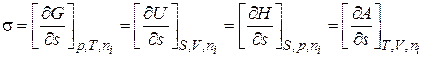 . (2.5)
. (2.5)
Поверхностное натяжение – частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянных соответствующих параметрах.
Наиболее часто поверхностное натяжение выражают через производную от энергии Гиббса, т.к. экспериментальные условия постоянства T и p легко осуществимы экспериментально.
Поверхностное натяжение индивидуальных веществ является в то же время удельной энергией Гиббса поверхности (энергией Гиббса, приходящейся на единицу площади поверхности):
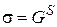 . (2.6)
. (2.6)
 2015-06-05
2015-06-05 8600
8600
