Английский физик Г. Мозли в 1913 г. предсказал, что заряд ядра атома
q,=Ze,
где е – элементарный электрический заряд;
Z – порядковый номер элемента в таблице Менделеева, определяет число электронов в атоме. Химические свойства зависят только от зарядового числа. Немецкие ученые В. Боте и Г. Беккер, изучая реакции (1930),происходящие при облучении бериллия α-частицами, обнаружили новое излучение, обладающее очень большой проникающей способностью.
В 1932 г. английский физик Дж. Чэдвик выдвинул гипотезу: бериллиевые лучи состоят из нейтральных частиц, масса которых близка к массе протона. Их назвали нейтронами.
Дальнейшие исследования показали, что нейтрон – нестабильная частица: свободный нейтрон за время 15 мин распадается на протон, электрон и нейтрино – частицу, лишенную массы покоя.
Масса нейтрона mn=1838,6 электронных масс, масса протона mp= 1836,1 электронных масс, mn > mp приблизительно на 2,5 массы электрона. После открытия нейтрона Д. Д. Иваненко и В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении ядра.
В ядре протон и нейтрон неразличимы, поэтому их называют нуклонами (ядерными частицами). Число протонов Z, число нейтронов N, массовое число – это суммарное число нуклонов в ядре А..
A – массовое число
Z – заряд ядра,
число протонов,
число электронов,
номер элемента в таблице Менделеева
N – число нейтронов
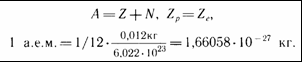
Обозначение химических элементов (ядер) в атомной и ядерной физике.
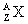 ,
,
где X – символ химического элемента.
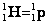 – протон;
– протон; 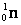 – нейтрон;
– нейтрон; 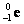 – электрон;
– электрон; 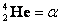 – частица;
– частица;
 2015-06-05
2015-06-05 892
892








