1. Идеальный газ и его свойства. Давление идеального газа. Распределение скоростей молекул. Опыт Штерна.
Идеальный газ — математическая модель газа, в которой предполагается, что:
1) потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией;
2) суммарный объём молекул газа пренебрежимо мал;
3) между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги;
4) время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Посмотри выше про давление.
Распределение скоростей
Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт являлся одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра. В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление. При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего серебро начинало испаряться и атомы серебра летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью v, определяемой температурой нагрева платиновой проволоки, т. е. температурой плавления серебра. Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее. Стенки цилиндров специально охлаждались, что способствовало оседанию попадающих на них атомов. В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра. Затем всю систему начинали вращать с некой достаточно большой угловой скоростью ω. При этом полоса налёта смещалась в сторону, противоположную направлению вращения, и теряла чёткость. Измерив смещение s наиболее тёмной части полосы от её положения, когда система покоилась, Штерн определил время полёта, через которое нашёл скорость движения молекул:
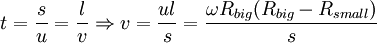 ,
,
где s — смещение полосы, l — расстояние между цилиндрами, а u — скорость движения точек внешнего цилиндра.
Найденная таким образом скорость движения атомов серебра совпала со скоростью, рассчитанной по законам молекулярно-кинетической теории, а тот факт, что получившаяся полоска была размытой, свидетельствовал в пользу того, что скорости атомов различны и распределены по некоторому закону — закону распределения Максвелла: атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее.
И немного про скорость
Тепловая скорость равна корню из среде квадратичной, равна √3RT/M
Средний модуль скорости √8RT/Mπ
 2015-06-05
2015-06-05 454
454








